题目内容
17.合金与纯金属制成的金属材料相比,合金的优点是( )①合金的硬度一般比它的各成分金属的硬度大
②一般地,合金的熔点比它的各成分金属的熔点更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛.
| A. | ①②③⑤ | B. | ②③④ | C. | ①②④ | D. | ①② |
分析 合金相对于组成它的金属来说,一般具有密度较小、熔点较低、耐腐蚀性强、硬度大、机械强度大等方面的特点.
解答 解:①与组成合金的纯金属相比,合金的优点一般硬度更大,故①正确;
②合金的熔点比它的各成分金属的熔点低,故②正确;
③不同的合金具有不同的性能,改变原料的配比、改变生成合金的条件,得到有不同性能的合金,故③正确;
④合金的导电性不一定比纯金属更强,比如铝合金的导电性比纯铝要差,故④错误;
⑤合金一般比成分金属熔点低,硬度大,具有更好的机械加工性能,故应用范围更广泛,故⑤正确;
故选A.
点评 本题考查合金的性质,题目难度不大,注意物质的组成和结构决定物质的性质,物质的性质决定物质的用途.

练习册系列答案
相关题目
17.以下有关物质的量浓度的叙述正确的是( )
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174 g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{4.0×74.5}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
5.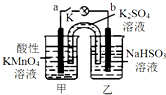 如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
 如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )| A. | 乙烧杯发生的反应:HSO3--2e-+H2O═SO42-+3H+ | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 | |
| D. | 外电路的电子方向是从b到a |
12.普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )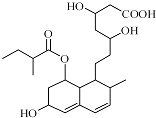

| A. | 该分子中有三种官能团 | B. | 能与FeCl3溶液发生显色反应 | ||
| C. | 能发生加成、取代、消去反应 | D. | 1mol该物质最多可与1molNaOH反应 |
9.X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法错误的是( )
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | 化合物乙中一定只有共价键 | |
| C. | W元素的某种单质可在电子工业用于生产半导体材料 | |
| D. | X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
6.下列离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀铜板:Fe3++2Cu═Fe2++2Cu2+ | |
| B. | 向1 mol/L硝酸溶液中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 在明矾溶液中滴加过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
7.下列有关金属的腐蚀与保护的说法正确的是( )
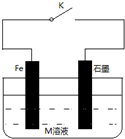

| A. | 常温下,关闭K时,若M溶液为浓硫酸,则石墨上有氢气放出 | |
| B. | 关闭K时,若M为氯化钠,则铁电极的电极反应式为:O2+4e-+2H2O═4OH- | |
| C. | 关闭K时,若M为则硫酸铵,则石墨极的电极反应式为:2H++2e-═H2↑ | |
| D. | 关闭K时,若M溶液为海水,石墨换成铜或银,则称为外加电流的阴极保护法 |
 .
.