题目内容
5.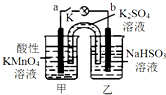 如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )| A. | 乙烧杯发生的反应:HSO3--2e-+H2O═SO42-+3H+ | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 | |
| D. | 外电路的电子方向是从b到a |
分析 图中装置为原电池,反应中高锰酸钾被还原,在酸性条件下生成Mn2+,甲中电极为原电池的正极,乙中亚硫酸钠被氧化,为原电池的负极,被氧化生成SO42-,结合电极方程式解答该题.
解答 解:A.乙中HSO3-被氧化,电极反应为HSO3--2e-+H2O=SO42-+3H+,故A正确;
B.甲为正极,阳离子向正极移动,故B正确;
C.电池工作时,甲烧杯中电极方程式为2MnO4-+16H++10e-=2Mn2++8H2O,反应消耗H+,硫酸浓度降低,则水电离出的c(H+)逐渐增大,故C错误;
D.b为负极,a为正极,则外电路的电子方向是从b到a,故D正确.
故选C.
点评 本题综合考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极方程式的书写,为解答该题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列物质属于非电解质一组的是( )
| A. | CO2、NH3、CH4 | B. | H2SO4、HNO3、BaCl2 | ||
| C. | CO2、NH3、Cu | D. | KNO3、NaOH、HCl |
10.下列实验的操作和解释均正确的是( )
| 实验内容 | 操作 | 解释 | |
| A | 去除二氧化硫中的混有的二氧化碳 | 氯化钡溶液洗气 | 二氧化碳能与氯化钡溶液反应 |
| B | 提纯含氯化铁杂质的氯化钠 | 重结晶 | 氯化铁和氯化钠的溶解度随温度变化差异大 |
| C | 分离乙酸和乙酸乙酯的混合物 | 萃取 | 乙酸和乙酸乙酯的混合物静置分层 |
| D | 分离乙醇和水的混合物 | 蒸馏 | 两者互溶且沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
10.NA为阿伏伽德罗常数的值.下列说法不正确的是( )
| A. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数目为$\frac{4}{15}$NA | |
| B. | 1molNa2O2固体中含离子总数为4NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
17.合金与纯金属制成的金属材料相比,合金的优点是( )
①合金的硬度一般比它的各成分金属的硬度大
②一般地,合金的熔点比它的各成分金属的熔点更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛.
①合金的硬度一般比它的各成分金属的硬度大
②一般地,合金的熔点比它的各成分金属的熔点更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛.
| A. | ①②③⑤ | B. | ②③④ | C. | ①②④ | D. | ①② |
14.下列物质的名称、俗名与化学式完全对应的是( )
| A. | 氯化钠 食盐 NaCl2 | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钙 熟石灰 CaO | D. | 氢氧化钠 火碱 NaOH |




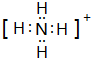 ,E分子的空间构型为三角锥形.
,E分子的空间构型为三角锥形.