题目内容
将NaClO3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaClO3和NaI恰好完全反应,生成 I2、Na2SO4和H2O,并产生棕黄色的气体X,则X为( )
| A、Cl2 |
| B、Cl2O |
| C、Cl2O3 |
| D、ClO2 |
考点:氧化还原反应的计算,氯、溴、碘及其化合物的综合应用
专题:氧化还原反应专题,卤族元素
分析:NaI被氧化为I2,为还原剂,则NaClO3中氯元素的化合价由+5价降低,反应中NaClO3为氧化剂,根据电子转移守恒计算Cl元素在还原产物中的化合价,以此计算.
解答:
解:NaI被氧化为I2,为还原剂,则NaClO3中氯元素的化合价由+5价降低,反应中NaClO3为氧化剂,
令Cl元素在还原产物中的化合价为a,则:1×(5-a)=1×(1-0),解得a=4,故棕黄色的气体X的化学式为ClO2,
故选D.
令Cl元素在还原产物中的化合价为a,则:1×(5-a)=1×(1-0),解得a=4,故棕黄色的气体X的化学式为ClO2,
故选D.
点评:本题考查氧化还原反应的有关计算,难度不大,注意从化合价变化判断氧化剂、还原剂、氧化产物、还原产物等概念,利用电子转移守恒计算.

练习册系列答案
相关题目
常温下,用0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL 0.10mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示,则下列说法正确的是( )
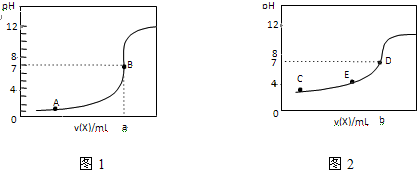

| A、图2是滴定盐酸的曲线 |
| B、a与b的关系是:a<b |
| C、E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、这两次滴定都可以用甲基橙作为指示剂 |
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4.下列关于该反应的说法正确的是( )
| A、CuSO4发生了氧化反应 |
| B、氧化产物和还原产物的物质的量之比为5:6 |
| C、白磷只作还原剂 |
| D、该反应中被硫酸铜氧化的白磷有3mol |
 已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )
已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )| A、常温常压下,L是一种液态有机物 |
| B、E的二溴代物只有一种结构 |
| C、G具有强氧化性和漂白性 |
| D、上述反应的类型是加成反应 |
我们生活在千变万化的物质世界里.下列变化中,没有发生氧化还原反应的是( )
| A、爆竹爆炸 | B、木炭燃烧 |
| C、蒸发 | D、电解水 |
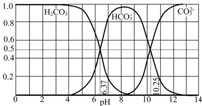 (1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应: