题目内容
COCl2(g)?CO(g)+Cl2(g)△H>0,当反应达到平衡时,下列措施:能提高COCl2转化率的是( )
①升温 ②加催化剂 ③增加CO浓度 ④减压.
①升温 ②加催化剂 ③增加CO浓度 ④减压.
| A、①② | B、①④ | C、②③ | D、③④ |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:化学反应COCl2(g)?CO(g)+Cl2(g)△H>0;是气体体积增大的反应,正向反应是吸热反应;转化率的变化根据化学平衡的移动方向分析判断.
①升温平衡向吸热反应方向移动;
②加催化剂,改变速率不改变平衡;
③增加CO的浓度,平衡逆向进行;
④减压平衡向气体体积增大的方向进行,平衡正向进行;
①升温平衡向吸热反应方向移动;
②加催化剂,改变速率不改变平衡;
③增加CO的浓度,平衡逆向进行;
④减压平衡向气体体积增大的方向进行,平衡正向进行;
解答:
解:化学反应COCl2(g)?CO(g)+Cl2(g)△H>0;是气体体积增大的反应,正向反应是吸热反应;
①升温平衡向吸热反应方向移动;平衡正向进行,COCl2转化率增大,故①符合;
②加催化剂,改变速率不改变平衡;COCl2转化率不变,故②不符合;
③增加CO的浓度,平衡逆向进行;COCl2转化率减小,故③不符合;
④减压平衡向气体体积增大的方向进行,平衡正向进行;COCl2转化率增大,故④符合;
综上所述:①④正确,
故选B.
①升温平衡向吸热反应方向移动;平衡正向进行,COCl2转化率增大,故①符合;
②加催化剂,改变速率不改变平衡;COCl2转化率不变,故②不符合;
③增加CO的浓度,平衡逆向进行;COCl2转化率减小,故③不符合;
④减压平衡向气体体积增大的方向进行,平衡正向进行;COCl2转化率增大,故④符合;
综上所述:①④正确,
故选B.
点评:本题考查了化学平衡的影响因素的分析判断,体积改变,平衡移动方向是判断的关键,题目难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
将NaClO3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaClO3和NaI恰好完全反应,生成 I2、Na2SO4和H2O,并产生棕黄色的气体X,则X为( )
| A、Cl2 |
| B、Cl2O |
| C、Cl2O3 |
| D、ClO2 |
下列离子不会对水体造成污染的是( )
| A、Ba2+ |
| B、Cl- |
| C、Cu2+ |
| D、Pb2+ |
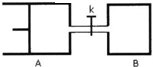 如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2molX和2molY,起始VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应x(g)+Y(g)?2Z(g)+w(g),达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K达新平衡后,升高B容器温度,A容器体积一定增大 |
| D、打开K一段时间达平衡时,A的体积为0.8aL(连通管中气体体积不计) |
已知1.505×1023个X气体分子的质量为16g,则X气体的摩尔质量是( )
| A、64g |
| B、32g |
| C、64g/mol |
| D、32g/mol |
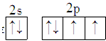 ,它的单质常温时为气态.试用化学符号回答以下问题.
,它的单质常温时为气态.试用化学符号回答以下问题.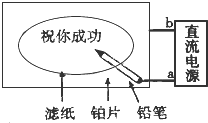 某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列
某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列