题目内容
5.下列物质性质与应用对应关系正确的是( )| A. | 金属钠与TiCl4溶液反应,可以置换出金属钛 | |
| B. | 氢氧化铝具有弱碱性,可用于做胃酸中和剂 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铁能与酸反应,可用于制作红色涂料 |
分析 A、将钠投入到TiCl4溶液中,钠会先与水反应;
B、氢氧化铝是两性氢氧化物;
C、漂白粉具有漂白性的原因是由于其具有强氧化性;
D、氧化铁固体为红棕色.
解答 解:A、将钠投入到TiCl4溶液中,钠会先与水反应,生成的氢氧化钠再与TiCl4反应,不能置换出金属钛,故A错误;
B、氢氧化铝是两性氢氧化物,有弱碱性,能和胃酸HCl反应,从而能治疗胃酸过多,故B正确;
C、漂白粉具有漂白性的原因是由于其具有强氧化性,与漂白粉在空气中的稳定性无关,故C错误;
D、氧化铁固体为红棕色,故可以做红色涂料,与其能和酸反应无关,故D错误.
故选B.
点评 本题考查了物质间的关系,明确物质的性质是解本题关键,根据其性质分析用途,掌握物质的性质,灵活运用知识解答,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
14.在蒸发皿中加热蒸干并灼烧(低于 300℃)下列物质的溶液,可以得到该固体溶质的是( )
| A. | 氯化铝 | B. | 亚硫酸钠 | C. | 硫酸镁 | D. | 碳酸氢钠 |
15.用NA表示阿伏加德罗常数的值,下列叙还正确的是( )
| A. | 在过氧化钠与水的反应中.固体每增重mg,转移电子为0.2NA | |
| B. | 在准状况下,2.24LCl2与过量NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数为6NA | |
| D. | 标准状况下,22.4LCCl4中含有的碳原子数目为NA |
13.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是( )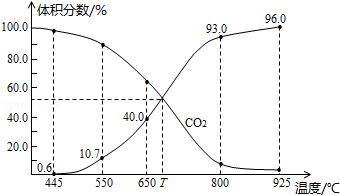
已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是( )

| A. | 550℃时,若充入惰性气体,v正,v逆均减小 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04P总 |
10.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸试剂的物质的量浓度为18.4 mol/L | |
| B. | 稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 | |
| C. | 50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol | |
| D. | 标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L |
17.给试管里的固体加热,下列操作中不正确的是( )
| A. | 如试管外壁有水,应在加热前擦拭干净 | |
| B. | 先使试管均匀受热,即先进行预热,然后把灯焰固定在放固体的部位加热 | |
| C. | 试管夹夹在距试管口约$\frac{1}{3}$处 | |
| D. | 加热完毕,立即用冷水冲洗试管 |
15.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24L丙烷中含有的共用电子对数为NA | |
| B. | 25℃时,pH=1的盐酸和醋酸溶液所含H+数均为0.1 NA | |
| C. | 利用双氧水制氧气,每生成1molO2转移电子数为4 NA | |
| D. | 100mL 12mo1•L-1的浓盐酸与足量MnO2加热反应,生成C12分子数为0.3 NA |
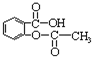 b.烯烃
b.烯烃 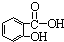 c.炔烃
c.炔烃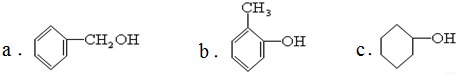
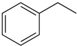 (g)→
(g)→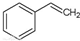 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; +CO(g)+H2O(g) △H=+158.8 kJ/mol
+CO(g)+H2O(g) △H=+158.8 kJ/mol