题目内容
10.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
| A. | 该硫酸试剂的物质的量浓度为18.4 mol/L | |
| B. | 稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 | |
| C. | 50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol | |
| D. | 标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L |
分析 A.根据c=$\frac{1000ρω}{M}$计算判断;
B.稀释该硫酸时应把浓硫酸倒入水中,边倒边搅拌;
C.Cu与浓硫酸在加热条件下反应,随反应进行,浓硫酸变稀,Cu与稀硫酸不反应;
D.标况下,Al在浓硫酸中发生钝化现象.
解答 解:A.根据c=$\frac{1000ρω}{M}$可知,该浓H2SO4的物质的量浓度=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A正确;
B.稀释该硫酸时应把浓硫酸倒入水中,边倒边搅拌,防止硫酸溅出伤人,故B错误;
C.50 mL溶液中H2SO4的物质的量为0.05L×18.4mol/L=0.92mol,若浓硫酸完全反应,由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,可知被还原硫酸为0.46mol,Cu与浓硫酸在加热条件下反应,随反应进行,浓硫酸变稀,Cu与稀硫酸不反应,故被还原的H2SO4的物质的量小于0.46 mol,故C错误;
D.标况下,Al在浓硫酸中发生钝化现象,故D错误,
故选:A.
点评 本题考查物质的量浓度计算、浓硫酸性质、实验基本操作等,注意理解掌握物质的量浓度与质量分数之间关系.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
19.化学概念在逻辑上存在如下关系:
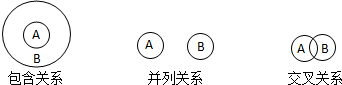
对下列概念的说法正确的是( )

对下列概念的说法正确的是( )
| A. | 纯净物与混合物属于包含关系 | |
| B. | 胶体与分散系属于交叉关系 | |
| C. | 置换反应与离子反应属于交叉关系 | |
| D. | 氧化还原反应与分解反应属于并列关系 |
1.下列有关物质性质的比较,错误的是( )
| A. | 溶解度(25℃):小苏打<苏打 | B. | 沸点:H2Se>H2S>H2O | ||
| C. | 密度:溴乙烷>水 | D. | 碳碳键键长:乙烯<苯 |
18.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 热稳定性:H2O>H2S | B. | 酸性:HCl>H2CO3 | ||
| C. | 金属性:K>Li | D. | 碱性:NaOH>Mg(OH)2 |
5.下列物质性质与应用对应关系正确的是( )
| A. | 金属钠与TiCl4溶液反应,可以置换出金属钛 | |
| B. | 氢氧化铝具有弱碱性,可用于做胃酸中和剂 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铁能与酸反应,可用于制作红色涂料 |
15.图标所警示的是( )


| A. | 氧化物 | B. | 易燃物质 | C. | 自燃物质 | D. | 爆炸物质 |
2.己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中正确的是( )

| A. | 该有机物属于芳香烃 | |
| B. | 该物质不能使酸性高锰酸钾溶液褪色 | |
| C. | 该分子对称性好,所以没有顺反异构 | |
| D. | 该有机物分子中,最多可能有18个碳原子共平面 |
19.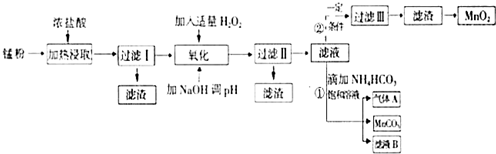 面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
根据以上信息回答问题:
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节PH的范围为8.5<PH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2 中加入过量酸化的0.50mol/L H2C2O4,50.00mL,MnO2 完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/L KMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).
 面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时PH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时PH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节PH的范围为8.5<PH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2 中加入过量酸化的0.50mol/L H2C2O4,50.00mL,MnO2 完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/L KMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).
20.下列关于安全事故的处理方法中,正确的是 ( )
| A. | 金属钠着火时,立即用水喷洒 | |
| B. | 大量氯气泄漏时,迅速离开现场,并尽量往高处去 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用大量水扑灭 | |
| D. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 |