题目内容
15.用NA表示阿伏加德罗常数的值,下列叙还正确的是( )| A. | 在过氧化钠与水的反应中.固体每增重mg,转移电子为0.2NA | |
| B. | 在准状况下,2.24LCl2与过量NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数为6NA | |
| D. | 标准状况下,22.4LCCl4中含有的碳原子数目为NA |
分析 A、根据Na2O2与H2O的反应可知:每增重2g,转移1mol电子;
B、求出氯气的物质的量,然后根据氯气与碱的反应为歧化反应来分析;
C、反应:2NH3+NO+NO2═2N2+3H2O转移6mol电子;
D、标况下四氯化碳为液态.
解答 解:A、根据Na2O2与H2O的反应:2Na2O2+2H2O=4NaOH+O2↑可知:此反应增重4g,转移2mol电子,即增重2g时,转移NA个电子,故当每增重mg,转移电子的数目为$\frac{m{N}_{A}}{2}$,故A错误;
B、标况下2.24L氯气的物质的量为0.1mol,而氯气与碱的反应为歧化反应,故0.1mol氯气转移0.1mol电子即0.1NA个,故B错误;
C、反应2NH3+NO+NO2═2N2+3H2O转移6mol电子,生成2mol氮气,故当生成2mol氮气时转移6mol电子即6NA个,故C正确;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和碳原子数目,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
5.下列化学式与指定物质的主要成分对应正确的是( )
| A. | CH4--天然气 | B. | CaO--熟石灰 | C. | Na2CO3--小苏打 | D. | NaHCO3--苏打粉 |
3.下列说法正确的是( )
| A. | 用核磁共振氢谱不能鉴别1-丙醇和2-丙醇 | |
| B. | 实验证实 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | 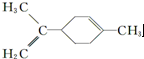 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 | |
| D. | 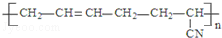 的单体是CH3-C≡C-CH3和CH2═CH-CN 的单体是CH3-C≡C-CH3和CH2═CH-CN |
1.下列有关物质性质的比较,错误的是( )
| A. | 溶解度(25℃):小苏打<苏打 | B. | 沸点:H2Se>H2S>H2O | ||
| C. | 密度:溴乙烷>水 | D. | 碳碳键键长:乙烯<苯 |
8.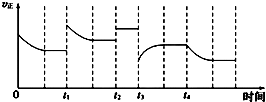 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,在反应过程中,正反应速率的变化如图,下列说法中正确的是( )
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,在反应过程中,正反应速率的变化如图,下列说法中正确的是( )
 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,在反应过程中,正反应速率的变化如图,下列说法中正确的是( )
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,在反应过程中,正反应速率的变化如图,下列说法中正确的是( )| A. | t1时升高了温度 | |
| B. | t2时恒压条件下加入了惰性气体 | |
| C. | t3时增大了压强 | |
| D. | t2、t3、t4三个时刻中t4时NH3的百分含量最低 |
5.下列物质性质与应用对应关系正确的是( )
| A. | 金属钠与TiCl4溶液反应,可以置换出金属钛 | |
| B. | 氢氧化铝具有弱碱性,可用于做胃酸中和剂 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铁能与酸反应,可用于制作红色涂料 |
6.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4 L的H2O中含有的分子数为NA | |
| B. | 7.8g Na2S固体和7.8 g Na2O2固体中含有的阴离子数目均为0.1NA | |
| C. | 46克 Na与足量氧气反应转移的电子数为2NA | |
| D. | 1 L 1mol•L-1 Na2CO3溶液中含有的钠离子数为NA |