题目内容
4.实验室用密度为1.25g•mL-1、溶质质量分数为36.5%的浓盐酸配制240mL 0.1mol•L-1的盐酸,请回答下列问题:(相对原子质量:H:1,Cl:35.5)(1)浓盐酸的物质的量浓度为12.5mol/L.
(2)配制240mL 0.1mol•L-1的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡[
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.定容,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处.
(4)操作A中,将洗涤液都移入容量瓶,其目的是洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中..
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
(2)依据配制溶液体积选择容量瓶规格;依据溶液稀释过程中溶质的物质的量不变,计算需要浓盐酸的体积;
(3)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,据此排序,依据洗涤和定容的正确操作填空;
(4)烧杯和玻璃棒上都沾有硫酸,洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中.
解答 解:(1)密度为1.25g•mL-1、溶质质量分数为36.5%的浓盐酸,物质的量浓度C=$\frac{1000×1.25×36.5%}{36.5}$=12.5mol/L;
故答案为:12.5mol/L;
(2)配制240mL 0.1mol•L-1的盐酸,实验室没有240mL容量瓶,应选择250mL容量瓶,实际配制250mL溶液,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×12.5mol/L=250mL×0.1mol/L,解得V=2.0mL,;
故答案为:2.0;250;
(3)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:BCAFED;
洗涤的操作为:用蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶;
定容的正确操作为:继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处,改用使溶液凹液面最低处恰好与刻度线相切;
故答案为:BCAFED;烧杯和玻璃棒;1-2cm;
(4)烧杯和玻璃棒上都沾有硫酸,洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中.
故答案为:洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择及使用方法和注意事项,题目难度不大.

| A. | 同系物的最简式相同,同分异构体的分子式相同 | |
| B. | 通式相同的是同系物,相对分子质量相同的是同分异构体 | |
| C. | 同系物的通式相同,同分异构体的相对分子质量相同 | |
| D. | 官能团相同的是同系物,含碳量相同的是同分异构体 |
| A. | 自然界中不存在游离态的硫 | |
| B. | 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 | |
| C. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| D. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 醛基的电子式: | ||
| C. | 乙酸的最简式:CH2O | D. | 乙醇分子比例模型: |
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| C. | 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH $→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| D. | 向小苏打溶液中加入醋酸:HCO3-+CH3COOH═CO2↑+H2O+CH3COO- |
 反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )
反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )| A. | 苯乙酮的一氯代物有6种同分异构体 | |
| B. | 苯乙酮经反应Ⅰ所得产物的所有原子不可能在同一平面内 | |
| C. | 反应Ⅱ为取代反应 | |
| D. | 反应Ⅱ可以在强碱性条件下进行 |
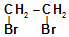 ..
..