题目内容
9.有关同系物和同分异构体的叙述正确的是( )| A. | 同系物的最简式相同,同分异构体的分子式相同 | |
| B. | 通式相同的是同系物,相对分子质量相同的是同分异构体 | |
| C. | 同系物的通式相同,同分异构体的相对分子质量相同 | |
| D. | 官能团相同的是同系物,含碳量相同的是同分异构体 |
分析 A.结构相似组成上相差CH2的有机物互为同系物,具有相同的通式,分子式相同结构不同的有机物为同分异构体;
B.通式相同的有机物不一定是同系物,相对分子质量相同的不一定是同分异构体;
C.结构相似组成上相差CH2的有机物互为同系物,具有相同的通式,同分异构体的分子式相同;
D.官能团相同的不一定是同系物,含碳量相同的不一定为同分异构体.
解答 解:A.结构相似组成上相差CH2的有机物互为同系物,具有相同的通式,同系物不一定最简式相同,如烷烃,分子式相同结构不同的有机物为同分异构体,故A错误;
B.通式相同的有机物不一定是同系物,如CnH2n可以是烯烃或环烷烃,相对分子质量相同的不一定是同分异构体,如C3H8和CO2相对分子质量为44,故B错误;
C.结构相似组成上相差CH2的有机物互为同系物,具有相同的通式,同分异构体的分子式相同,相对分子质量相同,故C正确;
D.官能团相同的不一定是同系物,如一元醇和二元醇,含碳量相同的不一定为同分异构体如烯烃中乙烯、丙烯等,故D错误;
故选C.
点评 本题考查有机物的结构和性质,侧重于同系物和同分异构体的理解,注意能举出反例,题目难度不大,掌握基础是解题关键.

练习册系列答案
相关题目
19.以下电子排布式不是基态原子的电子排布式的是( )
| A. | 1s22s1 | B. | 1s22s12p1 | C. | 1s22s22p63s2 | D. | 1s22s22p63s1 |
20.青蒿酸是合成青蒿素的原料,可以由香草醛合成: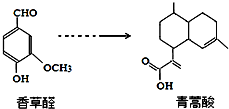 下列有关叙述正确的是( )
下列有关叙述正确的是( )
 下列有关叙述正确的是( )
下列有关叙述正确的是( )| A. | 香草醛的分子式是C8H10O3 | |
| B. | 香草醛能与NaHCO3溶液反应 | |
| C. | 两种物质均可与溴的四氯化碳溶液发生加成反应 | |
| D. | 可用FeCl3溶液检验青蒿酸中是否含香草醛 |
17.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA | |
| B. | 3.9g Na2O2晶体中含有0.2NA个离子 | |
| C. | 常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 3mol H2和1mol N2在一定条件下反应所得混合气体分子数小于2NA |
14.实验室用如图所示装置制备氯气并进行性质实验(必要时可加热,省略夹持装置).

(1)仪器a的名称是:分液漏斗;装置B中长颈漏斗的作用是:平衡装置中压强,防止玻璃仪器破裂.蒸馏烧瓶b中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)洗气装置B试剂是饱和食盐水,其作用是除去氯气中的氯化氢气体,分液漏斗D中发生反应的化学方程式为Cl2+2NaBr=Br2+2NaCl.
(3)装置C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,设计C装置的目的是验证氯气还是次氯酸具有漂白性.
(4)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(5)实验结束后将产生的氯气通入含紫色石蕊溶液的试管里,请填写表中的空白:

(1)仪器a的名称是:分液漏斗;装置B中长颈漏斗的作用是:平衡装置中压强,防止玻璃仪器破裂.蒸馏烧瓶b中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)洗气装置B试剂是饱和食盐水,其作用是除去氯气中的氯化氢气体,分液漏斗D中发生反应的化学方程式为Cl2+2NaBr=Br2+2NaCl.
(3)装置C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,设计C装置的目的是验证氯气还是次氯酸具有漂白性.
(4)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(5)实验结束后将产生的氯气通入含紫色石蕊溶液的试管里,请填写表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
1.关于化学式为[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )
| A. | 配位体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti3+,形成配位键时提供电子对 | |
| C. | 配离子是[TiCl(H2O)5]2+,内界和外界中的Cl-的数目比是1:2 | |
| D. | 向含1 mol该配合物的水溶液中加入足量AgNO3溶液,生成AgCl沉淀3 mol |
4.实验室用密度为1.25g•mL-1、溶质质量分数为36.5%的浓盐酸配制240mL 0.1mol•L-1的盐酸,请回答下列问题:(相对原子质量:H:1,Cl:35.5)
(1)浓盐酸的物质的量浓度为12.5mol/L.
(2)配制240mL 0.1mol•L-1的盐酸
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次,并将步骤A、E、F补充完整)BCAFED.
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡[
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.定容,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处.
(4)操作A中,将洗涤液都移入容量瓶,其目的是洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中..
(1)浓盐酸的物质的量浓度为12.5mol/L.
(2)配制240mL 0.1mol•L-1的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡[
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.定容,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处.
(4)操作A中,将洗涤液都移入容量瓶,其目的是洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中..
 盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用. ;
;