题目内容
14.下列化学方程式或离子方程式正确的是( )| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| C. | 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH $→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| D. | 向小苏打溶液中加入醋酸:HCO3-+CH3COOH═CO2↑+H2O+CH3COO- |
分析 A.苯酚的酸性大于碳酸氢根离子,二者反应生成的碳酸氢钠;
B.甲醛中含2个-CHO,生成4molAg;
C.在氢氧化钠的水溶液中,卤代烃发生水解反应,不发生消去反应;
D.小苏打为碳酸氢钠,碳酸钠与醋酸反应生成醋酸钠、二氧化碳气体和水.
解答 解:A.苯酚钠溶液中通入少量CO2,二者反应生成苯酚和碳酸氢钠,正确的离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故A错误;
B.甲醛溶液中加入足量的银氨溶液并加热的离子反应为HCHO+4[Ag(NH3)2]++4OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+2NH4++4Ag↓+6NH3+2H2O,故B错误;
C.1一氯丙烷中加入氢氧化钠溶液并加热,二者发生水解反应,正确的离子方程式为:CH3CH2CH2Cl+NaOH $→_{△}^{水}$CH3CH2CH2OH+NaCl,故C错误;
D.向小苏打溶液中加入醋酸,反应的离子反应为:HCO3-+CH3COOH═CO2↑+H2O+CH3COO-,故D正确;
故选D.
点评 本题考查离子方程式的书写,为高频考点,把握发生的化学反应为解答本题的关键,侧重有机物离子反应、氧化还原的考查,选项B为易错点,综合性较强,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
5.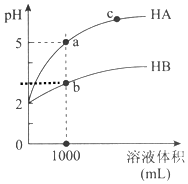 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:
(1)HB溶液体积稀释到1000毫升时,溶液中c(H+)=10-3mol/L.
(2)由图可判断:HA的酸性>(填“>”或“<”)HB的酸性.
(3)pH均为2的一元酸HA和HB各1mL,分别加水稀释后pH不同的原因是什么?请进行完整说明
.
 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:(1)HB溶液体积稀释到1000毫升时,溶液中c(H+)=10-3mol/L.
(2)由图可判断:HA的酸性>(填“>”或“<”)HB的酸性.
(3)pH均为2的一元酸HA和HB各1mL,分别加水稀释后pH不同的原因是什么?请进行完整说明
| 物质 | 稀释中变化 | 稀释中n(H+)变化 | 稀释中c(H+)减小程度 |
| HA | HA=H++A-不移动 | 不变 | 大 |
| HB | HB?H++B- 正向移动 | 增加 | 小 |
2.如图所示,a和b是盐酸和氢氧化钠溶液相互反应的pH值变化曲线,下列说法不正确的是( )

| A. | NaOH的物质的量浓度:c(NaOH)=0.1mol•L-1 | |
| B. | a和b曲线上的任何一点都有:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | P点溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) | |
| D. | 曲线b是氢氧化钠溶液中逐滴加入盐酸的pH值变化曲线 |
9.下列有机物分子中所有的原子不可能处于同一平面的是( )
| A. | 1,3-丁二烯 | B. | 乙烷 | C. | 苯乙烯 | D. | 甲醛 |
4.实验室用密度为1.25g•mL-1、溶质质量分数为36.5%的浓盐酸配制240mL 0.1mol•L-1的盐酸,请回答下列问题:(相对原子质量:H:1,Cl:35.5)
(1)浓盐酸的物质的量浓度为12.5mol/L.
(2)配制240mL 0.1mol•L-1的盐酸
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次,并将步骤A、E、F补充完整)BCAFED.
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡[
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.定容,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处.
(4)操作A中,将洗涤液都移入容量瓶,其目的是洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中..
(1)浓盐酸的物质的量浓度为12.5mol/L.
(2)配制240mL 0.1mol•L-1的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡[
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.定容,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面距离刻度线1-2cm处.
(4)操作A中,将洗涤液都移入容量瓶,其目的是洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中..
11.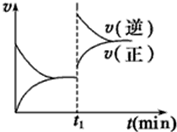 如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
 如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )| A. | 2SO2(g)+O2(g)?2SO3(g);△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H<0 | ||
| C. | H2(g)+I2(g)?2HI(g);△H>0 | D. | N2(g)+3H2(g)?2 NH3(g)△H<0 |
8.SiCl4的分子结构与CCl4相似,对其进行下列推测,不正确的是( )
| A. | SiCl4晶体是分子晶体 | |
| B. | 常温常压下SiCl4是气体 | |
| C. | SiCl4的分子 是由极性键形成的非极性分子 | |
| D. | SiCl4的熔点高于CCl4 |
9.下列属于取代反应的是( )
| A. | CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl | B. | C16H34 $→_{△}^{催化剂}$C8H18+C8H16 | ||
| C. | nCH2=CH2$\stackrel{催化剂}{→}$ | D. | C2H6O+3O2$\stackrel{点燃}{→}$2 CO2+3H2O |
 盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.