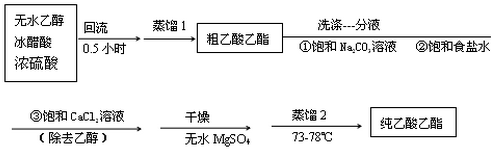
题目内容
17.下表列出了A-H八种短周期元素的原子半径和主要化合价.| 元素代号 | A | B | C | D | E | F | G | H |
| 原子半径/pm | 37 | 160 | 70 | 66 | 186 | 143 | 104 | 99 |
| 最高化合价 | +1 | +2 | +5 | +1 | +3 | +6 | +7 | |
| 最低化合价 | -3 | -2 | -2 | -1 |
(1)G在元素周期表中的位置是第三周期VIA族(填周期和族)
(2)上述八种元素中,最高价氧化物的水化物酸性最强的是HClO4(填化学式),气态氢化物水溶液pH>7的是NH3(填化学式);
(3)B、D、E、F四种元素的离子,其离子半径最大的是O2-(填离子符号);
(4)A2D的电子式是
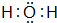 ,B、H两种元素形成化合物的电子式是
,B、H两种元素形成化合物的电子式是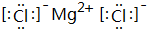 ;
;(5)A、C、H三种元素组成的化合物的化学式是NH4Cl,该化合物属于离子化合物(填“离子”或“共价”);
(6)E、F两种元素的最高价氧化物的水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
分析 短周期元素中,D、G均有-2价,处于VIA族,G有+6价且原子半径较大,故D为O元素、G为S元素;H有+7、-1价,则H为Cl;C有+5、-3价,处于VA族,原子半径小于Cl,故C为N元素;F有+3价,处于ⅢA族,原子半径大于S,故F为Al;A、E均有+1价,处于IA族,E的原子半径大于Al,故E为Na,A的原子半径小于氧,故A为H元素;B有+2价,处于ⅡA族,原子半径大于Al,故B为Mg.
解答 解:短周期元素中,D、G均有-2价,处于VIA族,G有+6价且原子半径较大,故D为O元素、G为S元素;H有+7、-1价,则H为Cl;C有+5、-3价,处于VA族,原子半径小于Cl,故C为N元素;F有+3价,处于ⅢA族,原子半径大于S,故F为Al;A、E均有+1价,处于IA族,E的原子半径大于Al,故E为Na,A的原子半径小于氧,故A为H元素;B有+2价,处于ⅡA族,原子半径大于Al,故B为Mg.
(1)G为S元素,在元素周期表中的位置:第三周期VIA族,故答案为:第三周期VIA族;
(2)上述八种元素中,最高价氧化物的水化物酸性最强的是HClO4,气态氢化物水溶液pH>7的是NH3,故答案为:HClO4;NH3;
(3)B、D、E、F四种元素的离子分别为Mg2+、O2-、Na+、Al3+,电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+>Mg2+>Al3+,故答案为:O2-;
(4)H2O的电子式是: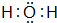 ,B、H两种元素形成化合物为MgCl2,电子式是
,B、H两种元素形成化合物为MgCl2,电子式是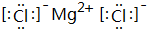 ,
,
故答案为: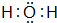 ;
;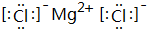 ;
;
(5)A、C、H三种元素组成的化合物的化学式是NH4Cl,该化合物属于离子化合物,
故答案为:NH4Cl;离子;
(6)E、F两种元素的最高价氧化物的水化物分别为NaOH、Al(OH)3,发生反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子半径推断元素,理解掌握元素周期律.

 阅读快车系列答案
阅读快车系列答案| A. | 由A和B两种元素形成的化合物BA5中含共价键 | |
| B. | 含C或E元素的某些物质具有杀菌消毒的作用,其原理相同 | |
| C. | 原子半径:D>C>B,离子半径B>C>D | |
| D. | 由A、C、E三种元素形成的某种化合物AEC,其结构式A-E-C |
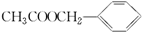 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: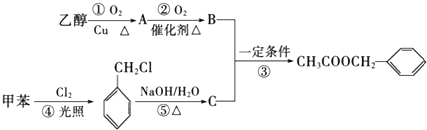
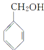 ,B中含氧官能团的名称是羧基.
,B中含氧官能团的名称是羧基. ;
; .
.