题目内容
4.以软锰矿(主要成份为MnO2和SiO2,含少量Al2O3)和闪锌矿(主要成份ZnS和SiO2,含少量FeS、CuS)为原料生产MnO2、锌及副产品Cu的工艺流程如下: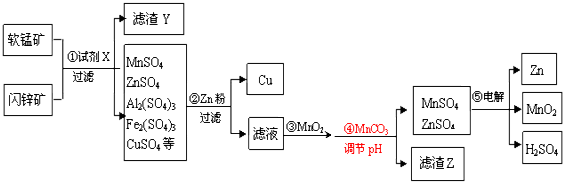
(1)试剂X的化学式为H2SO4.
(2)已知MnO2具有强氧化性,滤渣Y中含有一种单质,该单质是S;步骤③MnO2的作用是将Fe2+氧化为Fe3+.
(3)步骤②加Zn粉时,Zn与Fe2(SO4)3溶液反应的离子方程式为Zn+2Fe3+═Zn2++2Fe2+.
(4)步骤④发生反应的离子方程式为MnCO3+2H+═Mn2++CO2↑+H2O.
(5)已知:Ksp[ZnS]=2×10-22,Ksp[MnS]=2×10-10
Ksp[ZnCO3]=1.4×10-11,Ksp[MnCO3]=1.8×10-11
请利用上述数据,调节pH用MnCO3而不用MnS的原因是硫化锌的溶度积较小,若加入MnS调节pH时,可能会使锌离子转化成硫化锌沉淀.
(6)滤渣Z除MnCO3、ZnCO3外,主要成分为Al(OH)3 Fe(OH)3.
(7)步骤⑤的电解产物Zn、MnO2、H2SO4的物质的量之比是1:1:2.
分析 以软锰矿(主要成份为MnO2和SiO2,含少量Al2O3)和闪锌矿(主要成份ZnS和SiO2,含少量FeS、CuS)为原料生产MnO2、锌及副产品Cu,软锰矿和闪锌矿粉碎后加入试剂X为硫酸酸溶后得到滤渣Y为S、SiO2,得到滤液主要含有MnSO4、ZnSO4、Al2(SO4)3、Fe2(SO4)3、CuSO4等,加入过量的锌粉过滤得到滤渣为Cu、Zn,滤液为MnSO4、ZnSO4、Al2(SO4)3、FeSO4,加入MnO2氧化亚铁离子为铁离子,加入MnCO3调节溶液PH沉淀铝离子、铁离子、锌离子和部分锰离子,过滤得到沉淀主要为MnCO3、ZnCO3、Al(OH)3 Fe(OH)3、滤液为MnSO4、ZnSO4,电解混合溶液得到Zn、MnO2、H2SO4,据此分析判断,
解答 解:(1)分析可知X为H2SO4,
故答案为:H2SO4;
(2)MnO2具有强氧化性,硫离子被也会为硫单质,滤渣Y中含有一种单质为S,步骤③MnO2的作用是将Fe2+氧化为Fe3+,
故答案为:S;将Fe2+氧化为Fe3+;
(3)步骤②加Zn粉时,Zn与Fe2(SO4)3溶液反应的离子方程式为:Zn+2Fe3+═Zn2++2Fe2+,
故答案为:Zn+2Fe3+═Zn2++2Fe2+;
(4)步骤④发生反应的离子方程式为:MnCO3+2H+═Mn2++CO2↑+H2O,
故答案为:MnCO3+2H+═Mn2++CO2↑+H2O;
(5)调节pH用MnCO3而不用MnS的原因是:Ksp[ZnS]=2×10-22,Ksp[MnS]=2×10-10,Ksp[ZnCO3]=1.4×10-11,Ksp[MnCO3]=1.8×10-11,硫化锌的溶度积较小,若加入MnS调节pH时,可能会使锌离子转化成硫化锌沉淀,
故答案为:硫化锌的溶度积较小,若加入MnS调节pH时,可能会使锌离子转化成硫化锌沉淀;
(6)滤渣Z除MnCO3、ZnCO3外,主要成分为Al(OH)3;Fe(OH)3,
故答案为:Al(OH)3;Fe(OH)3;
(7)电解MnSO4、ZnSO4混合溶液,阳极电极反应Mn2+-2e-+2H2O=MnO2+4H+,阴极电极反应为Zn2++2e-=Zn,电子守恒得到步骤⑤的电解产物Zn、MnO2、H2SO4的物质的量之比是1:1:2,
故答案为:1:1:2.
点评 本题考查了物质分离提纯的实验过程分析、物质性质、离子沉淀条件、氧化还原反应的应用、电极原理等知识点,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | Mg(OH)2+2HCl═MgCl2+2H2O | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
①太阳光催化分解水制氢:2H2O(1)=2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(g)+H2O(g)=CO(g)+H2(g)△H2=+13.13kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ•mol-1
下列说法正确的是( )
| A. | 反应中电能转化为化学能 | |
| B. | 反应低温可以自发转化 | |
| C. | 上述反应若使用催化剂,能改变反应的△H | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ•mol-1 |
| A. | lmol Cl2与足量的铁充分反应,.转移的电子数为2NA | |
| B. | 标准状况下,11.2L水所含分子数为0.5NA | |
| C. | 常温常压下,22.4L氖气含有NA个氖原子 | |
| D. | 124g Na2O溶于水后所得溶液中含有O2-离子数为2NA |
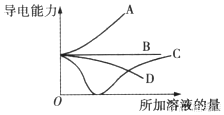
| A. | 曲线A表示NaOH溶液中滴加稀盐酸 | |
| B. | 曲线B表示CH3COOH溶液中滴加KOH溶液 | |
| C. | 曲线C表示Ba(OH)2溶液中滴加稀硫酸 | |
| D. | 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液 |
在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2molN2和0.6molH2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol•L-1•min-1.
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量氮气
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2B.v正(H2)=3v正(N2 )
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v正>v逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
(硫有-2、+4、+6价)
| A. | 硫单质有氧化性 | B. | 二氧化硫具有还原性 | ||
| C. | 硫酸可以被氧化 | D. | 硫化氢(H2S)可以被氧化 |
| A. | 银白色金属 | B. | 不与氧气反应 | ||
| C. | 能发生铝热反应 | D. | 能与氢氧化钠溶液反应 |