题目内容
11.四种基本反应类型判断不正确的是( )| A. | C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 化合反应 | |
| B. | CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑分解反应 | |
| C. | AgNO3+KCl═AgCl↓+KNO3复分解反应 | |
| D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
分析 两种或两种以上的物质反应生成一种物质的反应为化合反应;
一种物质反应生成两种或两种以上的物质的反应为分解反应;
两种化合物相互交换成分生成另外两种化合物的反应为复分解反应;
一种单质和一种化合物相互交换成分生成另外一种单质和化合物的反应为置换反应.
解答 解:A、两种或两种以上的物质反应生成一种物质的反应为化合反应,故C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 为化合反应,故A正确;
B、一种物质反应生成两种或两种以上的物质的反应为分解反应,故CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑为分解反应,故B正确;
C、两种化合物相互交换成分生成另外两种化合物的反应为复分解反应,反应AgNO3+KCl═AgCl↓+KNO3符合复分解反应的概念,故C正确;
D、一种单质和一种化合物相互交换成分生成另外一种单质和化合物的反应为置换反应,而Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 无单质参加,故不是置换反应,故D错误.
故选D.
点评 本题考查了四大基本反应类型的辨别,难度不大,掌握反应类型的概念是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.2-硝基-l,3-苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成.原理如下:
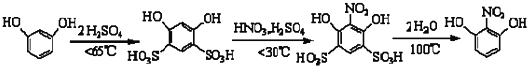
部分物质的相关性质如下:
制备过程如下:第一步:磺化.称取 71.5g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内 15min(如图 1).
第二步:硝化.待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌 l 5min.
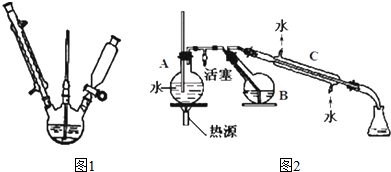
第三步:蒸馏.将硝化反应混物的稀释液转移到圆底烧瓶 B中,然后用图 2所示装置进行水 蒸气蒸馏.
请回答下列问题:
(1)实验室中把问苯二酚碾成粉末需要的仪器是研钵.
(2)磺化步骤中控制温度最合适的范围为(填字母)B.
A.30℃~60℃B.60℃~65℃C.65℃~70℃D.70℃~100℃
(3)硝化步骤中制取“混酸”的具体操作是在锥形瓶中加适量的浓硝酸,在摇荡下缓慢加入一定量的浓硫酸,冷却.
(4)图 2 中,烧瓶 A 中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小产生倒吸;直形冷凝管 C中可能出现的现象是有桔红色晶体析出.
(5)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的abc.
a.不溶或难溶于水,便于最后分离 b.在沸腾下与水不发生化学反应
c.具有一定的挥发性 d.具有较低的熔点
(6)本实验最终获得 12.0g桔红色晶体,则 2-硝基-1,3-苯二酚的产率约为11.9%.
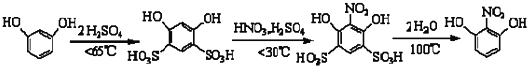
部分物质的相关性质如下:
| 名称 | 相对分子质量 | 性状 | 熔点 | 水溶性(常温) |
| 间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易容 |
| 2-硝基-1,3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
第二步:硝化.待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌 l 5min.

第三步:蒸馏.将硝化反应混物的稀释液转移到圆底烧瓶 B中,然后用图 2所示装置进行水 蒸气蒸馏.
请回答下列问题:
(1)实验室中把问苯二酚碾成粉末需要的仪器是研钵.
(2)磺化步骤中控制温度最合适的范围为(填字母)B.
A.30℃~60℃B.60℃~65℃C.65℃~70℃D.70℃~100℃
(3)硝化步骤中制取“混酸”的具体操作是在锥形瓶中加适量的浓硝酸,在摇荡下缓慢加入一定量的浓硫酸,冷却.
(4)图 2 中,烧瓶 A 中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小产生倒吸;直形冷凝管 C中可能出现的现象是有桔红色晶体析出.
(5)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的abc.
a.不溶或难溶于水,便于最后分离 b.在沸腾下与水不发生化学反应
c.具有一定的挥发性 d.具有较低的熔点
(6)本实验最终获得 12.0g桔红色晶体,则 2-硝基-1,3-苯二酚的产率约为11.9%.
6.下列有关氧气和二氧化碳的说法不正确的是( )
| A. | 自然界中的氧气和二氧化碳通过光合作用与呼吸作用可以相互转化 | |
| B. | 实验室制氧气和二氧化碳都可通过分解反应制得 | |
| C. | 氧气和二氧化碳都可以用向上排空气法收集 | |
| D. | 一般情况下,氧气能支持燃烧,二氧化碳不能支持燃烧 |
3.有一化学反应:A+3B?2C,根据影响化学反应速率的因素可得v(C)=kcm(A)cn(B),其中k是与温度有关的速率常数,为测k、m、n的值,在298K时,将A、B溶液按不同浓度混合,得到下列实验数据:
(1)根据上表可求得:m=1,n=2,k=1.2×10-2L2•mol-2•s-1.
(2)当c(A)=c(B)=2.0mol•L-1时,以B表示的初始反应速率为0.144mol•L-1•s-1.
| 编号 | A的初始浓 度/(mol•L-1) | B的初始浓 度/(mol•L-1) | 生成C的初始速 率/(mol•L-1•s-1) |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 1.0 | 2.0 | 4.8×10-2 |
(2)当c(A)=c(B)=2.0mol•L-1时,以B表示的初始反应速率为0.144mol•L-1•s-1.
14.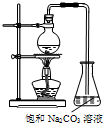 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:
CH3COOH+C2H5OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOC2H5+H2O
回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有(答出2点即可):增大乙醇浓度、移去生成物等.
(2)若用如图所示装置制备乙酸乙酯,产率往往偏低.其原因是(答出2点即可):原料来不及反应就被蒸出,或温度过高发生副反应;
(3)此反应以浓硫酸为催化剂,可能会造成(答出2点即可)产生大量酸性废液污染环境,或部分原料炭化等问题.
(4)目前对催化剂进行研究,发现质子酸(能提供H+)离子液体可用作此反应的催化剂,且能重复使用.实验数据如下(乙酸和乙醇等物质的量):
①根据表中数据,该反应的最佳条件是C.
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应达到120℃时,反应选择性降低的原因可能是:乙醇脱水生成乙醚.
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:CH3COOH+C2H5OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOC2H5+H2O
回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有(答出2点即可):增大乙醇浓度、移去生成物等.
(2)若用如图所示装置制备乙酸乙酯,产率往往偏低.其原因是(答出2点即可):原料来不及反应就被蒸出,或温度过高发生副反应;
(3)此反应以浓硫酸为催化剂,可能会造成(答出2点即可)产生大量酸性废液污染环境,或部分原料炭化等问题.
(4)目前对催化剂进行研究,发现质子酸(能提供H+)离子液体可用作此反应的催化剂,且能重复使用.实验数据如下(乙酸和乙醇等物质的量):
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度 | 转化率(%) | 选择性(%) | 反应时间 | 转化率(%) | 选择性(%) |
| 40℃ | 77.8 | 100 | 2h | 80.2 | 100 |
| 60℃ | 92.3 | 100 | 3h | 87.8 | 100 |
| 80℃ | 92.6 | 100 | 4h | 92.3 | 100 |
| 120℃ | 94.5 | 98.7 | 6h | 93 | 100 |
| 注:选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应达到120℃时,反应选择性降低的原因可能是:乙醇脱水生成乙醚.