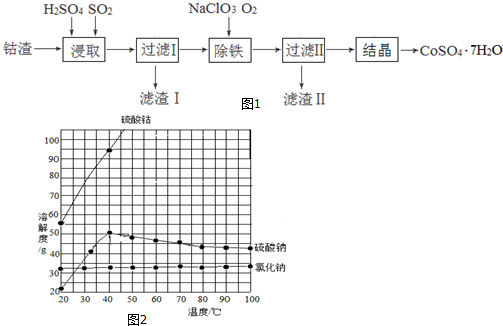
题目内容
3.有一化学反应:A+3B?2C,根据影响化学反应速率的因素可得v(C)=kcm(A)cn(B),其中k是与温度有关的速率常数,为测k、m、n的值,在298K时,将A、B溶液按不同浓度混合,得到下列实验数据:| 编号 | A的初始浓 度/(mol•L-1) | B的初始浓 度/(mol•L-1) | 生成C的初始速 率/(mol•L-1•s-1) |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 1.0 | 2.0 | 4.8×10-2 |
(2)当c(A)=c(B)=2.0mol•L-1时,以B表示的初始反应速率为0.144mol•L-1•s-1.
分析 (1)用B数据相同的两组,使A数据成倍数关系,即可求出m值(如选编号1、2两组);同样方法求出n值(如选编号1、3两组);将得到的m=1、n=2代入其中一组数据即可求出K,求得m、n、K值;
(2)利用方程式及反应速率表达式即可求出B的初始反应速率.
解答 解:(1)将1、2数据代入v0=kcm(A)cn(B),可得$\frac{{v}_{2}}{{v}_{1}}$=2m=2,m=1,将表中1、3数据代入v0=K{c(A)}m•{c(B)}n可得$\frac{{v}_{3}}{{v}_{1}}$=2n=4,m=2,
将m=1、n=2及数据1代入v0=kcm(A)cn(B)可得:K×1.01×1.02=1.2×10-2,解得K=1.2×10-2L2•mol-2•s-1,
故答案为:1;2;1.2×10-2L2•mol-2•s-1;
(2)当c(A)=c(B)=2.0mol•L-1时,v(C)=(1.2×10-2 L2•mol-2•s-1)×(2.0 mol•L-1)×(2.0 mol•L-1)2=9.6×10-2 mol•L-1•s-1,
以B表示的初始反应速率为9.6×10-2 mol•L-1•s-1×$\frac{3}{2}$=0.144mol•L-1•s-1,
故答案为:0.144mol•L-1•s-1.
点评 本题考查了化学反应速率的计算,题目难度中等.注意熟练掌握化学反应速率的概念及表达式,试题侧重学生的分析、理解能力及灵活应用所学知识的能力的培养.

练习册系列答案
相关题目
13.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐在低温碱性环境中稳定,易溶于水,难溶于无水乙醇等有机溶剂.
常见高铁酸钾的制备方法如下:
(1)干法制备反应中氧化剂和还原剂的物质的量之比为:3:1.
(2)某湿法制备高铁酸钾的基本流程及步骤如下:
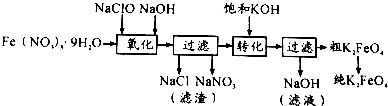
①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
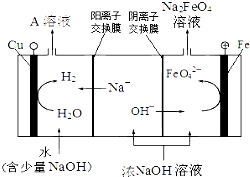
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是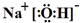 .
.
常见高铁酸钾的制备方法如下:
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
(2)某湿法制备高铁酸钾的基本流程及步骤如下:

①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是
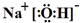 .
.
14. 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O
加酸歧化3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和cd.(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是生成K2SO4溶解度小,会降低产品的纯度;不宜用盐酸的原因是盐酸具有还原性,会被氧化,降低产品的量.
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2KOH+H2↑.与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ称取0.80g 左右的高锰酸钾产品,配成50mL溶液.
Ⅱ准确称取0.2014g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化.
Ⅲ将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点.记录消耗高锰酸钾溶液的体积,计算得出产品纯度.
①滴定过程中反应的离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②达到滴定终点的标志为锥形瓶中溶液突变为浅红色且半分钟内不褪色.
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度偏高.(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如右图,其原因可能为生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:熔融氧化3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O
加酸歧化3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是生成K2SO4溶解度小,会降低产品的纯度;不宜用盐酸的原因是盐酸具有还原性,会被氧化,降低产品的量.
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2KOH+H2↑.与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ称取0.80g 左右的高锰酸钾产品,配成50mL溶液.
Ⅱ准确称取0.2014g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化.
Ⅲ将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点.记录消耗高锰酸钾溶液的体积,计算得出产品纯度.
①滴定过程中反应的离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②达到滴定终点的标志为锥形瓶中溶液突变为浅红色且半分钟内不褪色.
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度偏高.(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如右图,其原因可能为生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
11.四种基本反应类型判断不正确的是( )
| A. | C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 化合反应 | |
| B. | CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑分解反应 | |
| C. | AgNO3+KCl═AgCl↓+KNO3复分解反应 | |
| D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
18.已知反应:2NO(g)+Br2(g)?2NOBr(g)的活化能为akJ•mol-1,其反应机理如下:
①NO(g)+Br2(g)?NOBr2(g)慢
②NO(g)+NOBr2(g)?2NOBr(g)快
下列有关该反应的说法正确的是( )
①NO(g)+Br2(g)?NOBr2(g)慢
②NO(g)+NOBr2(g)?2NOBr(g)快
下列有关该反应的说法正确的是( )
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
15.下列说法不正确的是( )
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 阿伏加德常数个微粒的物质的量是1 mol | |
| C. | 1 mol 12C原子的质量为12 g | |
| D. | 硫酸的摩尔质量是98 g |
5.某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子.某小组在实验室中用浸出萃取法制备硫酸铜:

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除去杂质、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2 mol•L-1 HCl、1 mol•L-1 H2SO4、0.1 mol•L-1 NaOH、0.1 mol•L-1BaCl2、蒸馏水.仪器和用品自选.
(4)上述实验需要100 mL 0.5 mol•L-1的CuSO4溶液,配制时需称取12.5g CuSO4•5H2O(化学式量:250).

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除去杂质、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2 mol•L-1 HCl、1 mol•L-1 H2SO4、0.1 mol•L-1 NaOH、0.1 mol•L-1BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |