题目内容
16.标况下,1.7g NH3的体积为2.24L,它1.5mol H2S含有相同数目的氢原子.分析 根据n=$\frac{m}{M}$计算出1.7g氨气的物质的量,最高价V=nVm计算出该氨气的体积;氢离子的数目相同,说明二者含有氢原子的物质的量相等,据此进行解答.
解答 解:1.7g NH3的物质的量为:$\frac{1.7g}{17g/mol}$=0.1mol,标准状况下0.1mol氨气的体积为:22.4L/mol×0.1mol=2.24L;
0.1mol氨气分子中含有H原子的物质的量为:0.1mol×3=0.3mol,含有相同数目的氢原子,说明二者含有H的物质的量相等,则需要H2S的物质的量为:$\frac{0.3mol}{2}$=0.15mol,
故答案为:2.24;1.5.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量之间的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
4.工业上常用铁质容器盛装冷浓硫酸,为研究铁材料与热浓硫酸的反应,某学习小组称取铁钉6.0g放入15.0mL浓硫酸中,加热.充分反应后得到溶液X并收集到气体Y.甲同学认为X中除含Fe3+外还可能含有Fe2+.若要确认其中Fe2+,应选用( )
| A. | KSCN溶液和氯水 | B. | 铁粉和KSCN溶液 | C. | 浓氨水 | D. | 酸性KMnO4溶液 |
11.四种基本反应类型判断不正确的是( )
| A. | C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 化合反应 | |
| B. | CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑分解反应 | |
| C. | AgNO3+KCl═AgCl↓+KNO3复分解反应 | |
| D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
5.化学反应原理模块中涉及很多常数,下列说法中不正确的是( )
| A. | 对于同类型反应,化学平衡常数K的大小反映了化学反应可能进行的程度 | |
| B. | 化学反应速率常数k与浓度无关,但受温度、催化剂、固体表面性质等因素的影响 | |
| C. | 水的离子积常数Kw、电离平衡常数Ka与温度有关,不受溶液的酸碱性影响 | |
| D. | 溶度积常数Ksp与难溶电解质的性质和温度无关,只与沉淀的量有关 |
19.硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得. 已知:Na2S2O3在酸性溶液中不能稳定存在.
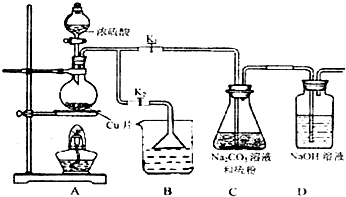
(1)某研究小组设计了制备Na2S203•5H20装置和部分操作步骤如下.
I.打开K1关闭K2,向圆底 烧瓶中加入足量浓硫酸加热.
II.C中混合液被气流搅动,反应一段时间后,硫粉逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热.
III.过滤C中的混合液.
IV.将滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干,得到产品Na2S203.5H20.
回答下列问题:
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因S2O32-+2H+═S↓+SO2↑+H2O(用离子方程式表示).
②IV中,操作步骤是蒸发浓缩、冷却结晶.
③装置B中盛放的试剂是(填化学式)NaOH溶液.
(2)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO${\;}_{4}^{2-}$全部转化为Cr2O${\;}_{7}^{2-}$;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
部分反应离子方程式为:
①Cr2O${\;}_{7}^{2-}$+6I-+14H+═2Cr3++3I2+7H2O;
②I2+2S2O${\;}_{3}^{2-}$═2I-+S4O${\;}_{6}^{2-}$.
Ⅰ.判断达到滴定终点的现象是加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变
Ⅱ.从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为18.00 ml
Ⅲ.废水中Ba2+的物质的量浓度2.4×10-4mol•L-1.

(1)某研究小组设计了制备Na2S203•5H20装置和部分操作步骤如下.
I.打开K1关闭K2,向圆底 烧瓶中加入足量浓硫酸加热.
II.C中混合液被气流搅动,反应一段时间后,硫粉逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热.
III.过滤C中的混合液.
IV.将滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干,得到产品Na2S203.5H20.
回答下列问题:
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因S2O32-+2H+═S↓+SO2↑+H2O(用离子方程式表示).
②IV中,操作步骤是蒸发浓缩、冷却结晶.
③装置B中盛放的试剂是(填化学式)NaOH溶液.
(2)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO${\;}_{4}^{2-}$全部转化为Cr2O${\;}_{7}^{2-}$;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
①Cr2O${\;}_{7}^{2-}$+6I-+14H+═2Cr3++3I2+7H2O;
②I2+2S2O${\;}_{3}^{2-}$═2I-+S4O${\;}_{6}^{2-}$.
Ⅰ.判断达到滴定终点的现象是加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变
Ⅱ.从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为18.00 ml
Ⅲ.废水中Ba2+的物质的量浓度2.4×10-4mol•L-1.
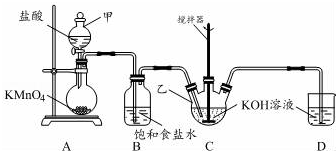 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4. 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.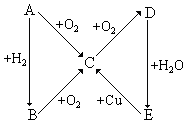 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.