题目内容
19.全氯丁烷(C4Cl10)可做耐火材料.已知氯元素有两种稳定的同位素35 Cl和37 Cl,则C435Cl837Cl2的分子结构有(不含立体异构)( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
分析 C4Cl10可以看成C435Cl10的二元取代产物,其中37Cl可以取代35Cl原子;丁烷两种同分异构:一种是正丁烷的结构,所以C4Cl10也有2种结构:一种是四个碳原子一字排开的类似正丁烷结构、一种是类似异丁烷有支链的结构,据此回答.
解答 解:C4Cl10可以看成C435Cl10的二元取代产物,其中2个37Cl可以取代2个35Cl原子,C4Cl10也有2种结构,一种是四个碳原子一字排开的类似正丁烷结构,一种是类似异丁烷有支链的结构.四个碳原子一字排开的类似正丁烷结构的C4Cl10两个37Cl2在不同碳原子上的有4种,两个37Cl2在相同碳原子上的有2种,共计六种;类似异丁烷有支链的结构的C4Cl10两个37Cl2在不同碳原子上的有2种,在同一个碳原子上的有一种,共三种,所以C435Cl837Cl2的分子结构有9种.
故选C.
点评 本题考查学生有机物的同分异构体的书写知识,可以根据教材知识来回答,难度不大,注意解题方法的掌握可以节省解题时间.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.实验室采用简易装置模拟演示工业炼铁原理.实验装置图和实验步骤如下:
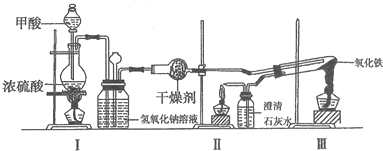
①按如图连接好装置,检查装置气密性.
②称取适量Fe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下分解,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式为HCOOH $→_{△}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③“某项操作”是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为Ⅲ、I、II.(用“I”、“Ⅱ”、“Ⅲ”表示)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃时,Fe能稳定存在,在680~710℃之间时,FeO能稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因:长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如表:
分析各元素的质量分数可知前两种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种可能.
(6)通过进一步的仪器分析测出前两种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式所得混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数).

①按如图连接好装置,检查装置气密性.
②称取适量Fe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下分解,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式为HCOOH $→_{△}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③“某项操作”是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为Ⅲ、I、II.(用“I”、“Ⅱ”、“Ⅲ”表示)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃时,Fe能稳定存在,在680~710℃之间时,FeO能稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因:长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如表:
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过进一步的仪器分析测出前两种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式所得混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数).
14. 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O
加酸歧化3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和cd.(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是生成K2SO4溶解度小,会降低产品的纯度;不宜用盐酸的原因是盐酸具有还原性,会被氧化,降低产品的量.
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2KOH+H2↑.与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ称取0.80g 左右的高锰酸钾产品,配成50mL溶液.
Ⅱ准确称取0.2014g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化.
Ⅲ将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点.记录消耗高锰酸钾溶液的体积,计算得出产品纯度.
①滴定过程中反应的离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②达到滴定终点的标志为锥形瓶中溶液突变为浅红色且半分钟内不褪色.
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度偏高.(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如右图,其原因可能为生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:熔融氧化3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O
加酸歧化3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是生成K2SO4溶解度小,会降低产品的纯度;不宜用盐酸的原因是盐酸具有还原性,会被氧化,降低产品的量.
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2KOH+H2↑.与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ称取0.80g 左右的高锰酸钾产品,配成50mL溶液.
Ⅱ准确称取0.2014g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化.
Ⅲ将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点.记录消耗高锰酸钾溶液的体积,计算得出产品纯度.
①滴定过程中反应的离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②达到滴定终点的标志为锥形瓶中溶液突变为浅红色且半分钟内不褪色.
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度偏高.(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如右图,其原因可能为生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
4.工业上常用铁质容器盛装冷浓硫酸,为研究铁材料与热浓硫酸的反应,某学习小组称取铁钉6.0g放入15.0mL浓硫酸中,加热.充分反应后得到溶液X并收集到气体Y.甲同学认为X中除含Fe3+外还可能含有Fe2+.若要确认其中Fe2+,应选用( )
| A. | KSCN溶液和氯水 | B. | 铁粉和KSCN溶液 | C. | 浓氨水 | D. | 酸性KMnO4溶液 |
11.四种基本反应类型判断不正确的是( )
| A. | C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 化合反应 | |
| B. | CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑分解反应 | |
| C. | AgNO3+KCl═AgCl↓+KNO3复分解反应 | |
| D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.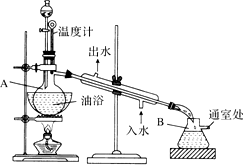 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.