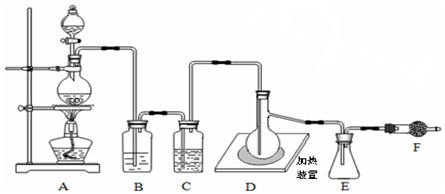
题目内容
7.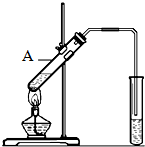 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:(1)乙醇的官能团名称是羟基
(2)乙酸的官能团的名称是羧基
(3)除去乙酸乙酯中的乙酸用饱和碳酸钠溶液(填试剂名称)
(4)乙酸能发生酯化反应.实验室用如图所示装置制取乙酸乙酯,在试管A中加入的试剂有浓硫酸、醋酸和乙醇.请写出该反应的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
分析 (1)乙醇中官能团为-OH;
(2)乙酸中官能团为-COOH;
(3)乙酸与饱和碳酸钠溶液反应,乙酸乙酯与饱和碳酸钠溶液分层;
(4)乙醇与乙酸发生酯化反应生成乙酸乙酯和水.
解答 解:(1)乙醇中官能团为-OH,名称为羟基,故答案为:羟基;
(2)乙酸中官能团为-COOH,名称为羧基,故答案为:羧基;
(3)乙酸与饱和碳酸钠溶液反应,乙酸乙酯与饱和碳酸钠溶液分层,则除去乙酸乙酯中的乙酸用饱和碳酸钠溶液,分液可除杂,故答案为:饱和碳酸钠溶液;
(4)乙醇与乙酸发生酯化反应生成乙酸乙酯和水,反应为CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意混合物分离提纯,题目难度不大.

练习册系列答案
相关题目
10.150℃时,一定质量的(NH4)2CO3完全分解产生的气体混合物的平均摩尔质量在数值上等于( )
| A. | 30.5 | B. | 26.3 | C. | 26 | D. | 24 |
2.工业上利用电镀污泥 (主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质) 回收铜和铬等金属,回收流程如图1:
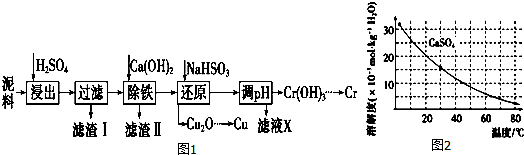
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有CuSO4.
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].

已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH到约3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持 c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].
17.若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,可能共存的是( )
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |

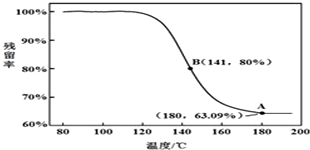
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质: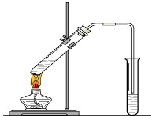 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: