题目内容
12. 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:(1)可使紫色石蕊试液变红色,说明乙酸具有酸性.
(2)能发生酯化反应.实验室用如图所示装置制取乙酸乙酯,在试管A中加入的试剂有乙醇(填写名称)、浓硫酸和冰醋酸,请写出该反应的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,浓硫酸在反应中起催化剂(或吸水剂)(填一种即可)作用,生成的乙酸乙酯密度比水小(填“大”或“小”),并可以闻到有香味.
分析 (1)乙酸含-COOH,具有酸性,可使紫色石蕊变红;
(2)由制备实验装置可知,A中乙醇、乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,该反应为可逆反应、且浓硫酸具有吸水性,生成的乙酸乙酯不溶于水,密度比水的密度小,且乙酸乙酯具有香味,以此来解答.
解答 解:(1)乙酸可使紫色石蕊试液变红色,说明乙酸具有酸性,故答案为:红;酸;
(2)实验室用如图所示装置制取乙酸乙酯,在试管A中加入的试剂有乙醇、浓硫酸和冰醋酸,该反应的化学方程式为CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,浓硫酸在反应中起催化剂、吸水剂作用,生成的乙酸乙酯密度比水小,并可以闻到有香味,
故答案为:乙醇;CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O;催化剂(或吸水剂);小;香.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意乙酸性质的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.(Ⅰ)氨基甲酸铵(NH2COONH4)的制备氨基甲酸铵是一种白色固体,易分解、易水解,难溶于CCl4.可用做肥料.
制备氨基甲酸铵的装置如图1所示.反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.

注:四氯化碳与液体石蜡均为惰性介质.
(1)发生器用冰水冷却的原因是降低温度,防止因反应放热造成产物分解.提高反应物转化率.
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.80℃热风下烘干 b.60℃热风下烘干 c.40℃热风下烘干
(4)尾气处理装置如图2所示.双通玻璃管的作用:防止倒吸;
浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
(Ⅱ) FeSO4•7H2O晶体的制备
(6)已知:
某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,制备绿矾(FeSO4•7H2O),补充完整由硫铁矿烧渣制备FeSO4•7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):
①向一定量烧渣中加入足量的稀硫酸充分反应,充分反应后过滤,
②向滤液加入足量的铁粉,充分搅拌后,过滤,
③滤液中滴加NaOH溶液调节反应液的pH约为5.0~5.8,过滤,
④将得到溶液加热蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥,得到FeSO4•7H2O晶体.
制备氨基甲酸铵的装置如图1所示.反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.

注:四氯化碳与液体石蜡均为惰性介质.
(1)发生器用冰水冷却的原因是降低温度,防止因反应放热造成产物分解.提高反应物转化率.
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.80℃热风下烘干 b.60℃热风下烘干 c.40℃热风下烘干
(4)尾气处理装置如图2所示.双通玻璃管的作用:防止倒吸;
浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
(Ⅱ) FeSO4•7H2O晶体的制备
(6)已知:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
①向一定量烧渣中加入足量的稀硫酸充分反应,充分反应后过滤,
②向滤液加入足量的铁粉,充分搅拌后,过滤,
③滤液中滴加NaOH溶液调节反应液的pH约为5.0~5.8,过滤,
④将得到溶液加热蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥,得到FeSO4•7H2O晶体.
4.已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{c(C)×c(D)}{c(A)×c(B)}$,△H=>0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1.则A的平均反应速率v(A)=0.025mol/(L.s).该反应达到平衡时A的转化率为80%,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为不变(填”变大“、”变小“或”不变“)
(3)判断反应是否达到平衡的依据为c(填字母代号).
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50mol D,此时v正大于v逆(填”大于“、”小于“或”等于“).
| |温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
| 平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
(1)该反应的平衡常数表达式K=$\frac{c(C)×c(D)}{c(A)×c(B)}$,△H=>0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1.则A的平均反应速率v(A)=0.025mol/(L.s).该反应达到平衡时A的转化率为80%,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为不变(填”变大“、”变小“或”不变“)
(3)判断反应是否达到平衡的依据为c(填字母代号).
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50mol D,此时v正大于v逆(填”大于“、”小于“或”等于“).
1.下列有关物质的分类正确的是( )
| A. | 纯净物:水银、氢氧化铁固体、冰水混合物 | |
| B. | 碱性氧化物:Na2O、Na2O2、Al2O3 | |
| C. | 盐:纯碱、小苏打、烧碱 | |
| D. | 电解质:CH3COOH、H2O、NH3 |

 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.
与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.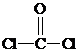 ,其中碳氧原子之间共价键是c(填序号)
,其中碳氧原子之间共价键是c(填序号)
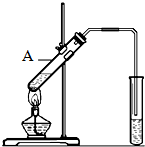 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质: 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.