题目内容
13.与CO互为等电子体的是( )| A. | CO2 | B. | N2 | C. | HCl | D. | O2 |
分析 先根据具有相同价电子数和相同原子数的分子或离子是等电子体,然后判断电子的数目来解答.
解答 解:A、二氧化碳是3原子,而一氧化碳是2原子,所以不是等电子体,故A错误;
B、N2的价电子数为5×2=10,而CO的电子数为4+6=10,都是双原子,所以两者是等电子体,故B正确;
C、氯化氢的价电子数是7+1=8,而CO的电子数为4+6=10,价电子数不等,所以不是等电子体,故C错误;
D、氧气的价电子数是6×2=12,而CO的电子数为4+6=10,价电子数不等,所以不是等电子体,故D错误;
故选B.
点评 本题主要考查了等电子体,解答本题的关键是要充分理解等电子体的本质特征,只有这样才能对问题做出正确的判断,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
3.某实验小组利用硫酸酸化的KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”.该小组实验方案如表(实验测定KMnO4溶液完全褪色时间).回答下列问题:
(1)上述反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)t1> t2(填“>”、“<”、“=”),其理由是①②两组温度相同,①中H2C2O4溶液浓度小于②
(3)实验②和实验③两组实验的目的是探究浓度不变时,温度对化学反应速率影响
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快.针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.
猜想②:Mn2+对该化学反应起催化作用(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是B.
A.硫酸钾B.硫酸锰C.水 D.氯化锰.
| 实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
(2)t1> t2(填“>”、“<”、“=”),其理由是①②两组温度相同,①中H2C2O4溶液浓度小于②
(3)实验②和实验③两组实验的目的是探究浓度不变时,温度对化学反应速率影响
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快.针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.
猜想②:Mn2+对该化学反应起催化作用(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是B.
A.硫酸钾B.硫酸锰C.水 D.氯化锰.
4.硒为第四周期VIA族元素,根据它在元素周期表中位置推测,硒不可能具有的性质是( )
| A. | 硒的氧化性比硫弱 | B. | 可以存在至少三种以上的化合价 | ||
| C. | SeO3对应水化物的酸性比HBrO4弱 | D. | 硒化氢的分子式为SeH3 |
1.下列表示物质结构的化学用语正确的是( )
| A. | Na2S的电子式: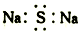 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 18O的原子结构示意图: | D. | HClO分子的结构式:H-Cl-O |
8.同温同压下,四个等体积的干燥圆底烧瓶中分别充满:①NH3 ②HCl(混有少量空气),③NO2,④NO2和O2(4:1)的混合气体,进行喷泉实验,经充分反应后,圆底瓶内溶液的物质的量浓度为(设溶质不扩散)( )
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①>②>③=④ |
18.近年来我国加强了稀土资源的保护.铈(Ce)是一种稀土元素,它的一种核素中含有58个质子和80个中子,则其表示为( )
| A. | ${\;}_{58}^{80}$Ce | B. | ${\;}_{58}^{138}$Ce | C. | ${\;}_{80}^{58}$Ce | D. | ${\;}_{80}^{138}$Ce |
5.如图,将锌片和铜片用导线连接后放入稀硫酸中,下列有关说法中正确的是( )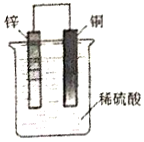

| A. | 铜片为电池的负极 | |
| B. | SO42-向负极移动 | |
| C. | 电子从铜片流向锌片 | |
| D. | 铜片上发生的电极反应为Cu-2e-═Cu2+ |
2.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应Fe2O3+3Na2O2$\frac{\underline{\;熔融\;}}{\;}$2Na2FeO4+Na2O,下列说法不正确的是( )
| A. | 该反应中Na2O2既是氧化剂又是还原剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 1mol Na2O2发生反应,有2mol电子转移 | |
| D. | 在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 |