题目内容
在NaCl、NaOH、N2、H2S中,只含有离子键的是 ,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又有极性键的是 ,用电子式表示NaCl和HCl的形成过程 ; .
考点:离子化合物的结构特征与性质,用电子式表示简单的离子化合物和共价化合物的形成,极性键和非极性键
专题:化学用语专题,化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间存在极性键,同种非金属元素之间存在非极性键,Na原子和Cl原子之间通过得失电子形成离子键,H原子和Cl原子之间通过共用电子对形成共价键.
解答:
解:NaCl中钠离子和氯离子之间只存在离子键,NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,氮气分子中只存在非极性键,硫化氢分子中S原子和H原子之间只存在极性键,所以只含离子键的是NaCl,只含极性键的是H2S,只含非极性键的是N2,既含离子键又含极性键的是NaOH,
NaCl的形成过程为 ,HCl的形成过程为
,HCl的形成过程为 ,
,
故答案为:NaCl;H2S;N2;NaOH; ;
; .
.
NaCl的形成过程为
 ,HCl的形成过程为
,HCl的形成过程为 ,
,故答案为:NaCl;H2S;N2;NaOH;
 ;
; .
.
点评:本题考查了化学键的判断、用电子式表示物质形成过程,明确物质的构成微粒及微粒间作用力即可判断化学键,用电子式表示物质形成构成为学习难点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
0.1mol某单质跟足量的硫充分反应后,其质量增加1.6g.则组成这种单质的元素可能是( )
| A、Cu | B、Al | C、Zn | D、Fe |

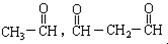 ,试写出该烃的结构简式.
,试写出该烃的结构简式.