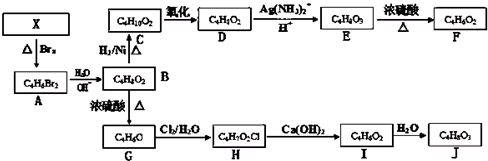
题目内容
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):
已知:A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的酸性混合液.
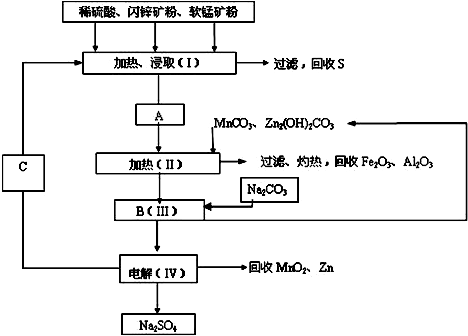
(1)A中属于还原产物的是 .
(2)加入MnCO3、Zn2(OH)2CO3的作用是 .
(3)请写出IV中电解的阳极反应式 .
(4)电解IV分离出的产物C的化学式是 .
(5)该生产中除得到MnO2和Zn以外,还可得到的副产品有Na2SO4、Fe2O3和 .
(6)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是 .(填名称)
已知:A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的酸性混合液.

(1)A中属于还原产物的是
(2)加入MnCO3、Zn2(OH)2CO3的作用是
(3)请写出IV中电解的阳极反应式
(4)电解IV分离出的产物C的化学式是
(5)该生产中除得到MnO2和Zn以外,还可得到的副产品有Na2SO4、Fe2O3和
(6)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题,元素及其化合物
分析:分析流程软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)加入硫酸酸溶,加热酸浸过滤得到A为A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的酸性混合液,加热过滤回收Fe2O3,Al2O3,加入碳酸钠沉淀锰离子和锌离子,得到滤液电解得到 二氧化锰和硫酸钠;
(1)比较信息①A与软锰矿中元素化合价的变化可知,A中还原产物为MnSO4.
(2)由工艺流程可知,A中加入MnCO3、Zn2(OH)2CO3,A中的Fe3+、Al3+,经过一系列操作转化为氧化铁、氧化铝,Fe3+、Al3+沉淀时容易形成胶体,不利于氢氧化铁、氢氧化铝沉降;
(3)依据电解原理分析,IV中电解的阳极反应为锰离子失电子生成二氧化锰,结合电荷守恒书写;
(4)操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用;
(5)根据流程图不难得出副产物有Na2SO4、Fe2O3和硫、氧化铝等;
(6)除矿石外,需加入的物质,就是要购买的化工原料.
(1)比较信息①A与软锰矿中元素化合价的变化可知,A中还原产物为MnSO4.
(2)由工艺流程可知,A中加入MnCO3、Zn2(OH)2CO3,A中的Fe3+、Al3+,经过一系列操作转化为氧化铁、氧化铝,Fe3+、Al3+沉淀时容易形成胶体,不利于氢氧化铁、氢氧化铝沉降;
(3)依据电解原理分析,IV中电解的阳极反应为锰离子失电子生成二氧化锰,结合电荷守恒书写;
(4)操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用;
(5)根据流程图不难得出副产物有Na2SO4、Fe2O3和硫、氧化铝等;
(6)除矿石外,需加入的物质,就是要购买的化工原料.
解答:
解:(1)比较信息①A与软锰矿中元素化合价的变化可知,Mn元素化合价由+4价降低为+2价,所以A中还原产物为MnSO4.
故答案为:MnSO4.
(2)由工艺流程可知,MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全;
故答案为:增大溶液的pH,使Fe3+和 Al3+生成沉淀;
(3)依据电解原理分析,IV中电解的阳极反应为锰离子失电子生成二氧化锰,结合电荷守恒书写得到阳极反应式为:Mn2++2H2O-2e-=MnO2+4H+;
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
(4)操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用,电解IV分离出的产物C的化学式是H2SO4;
故答案为:H2SO4;
(5)生产中除得到MnO2和Zn以外,还可得到的副产品有Na2SO4、Fe2O3,根据流程图可知,副产物有硫、氧化铝.
故答案为:Al2O3、S;
(6)根据流程图可知,需要加入碳酸钠、硫酸,所以除矿石外,需购买的化工原料是碳酸钠、硫酸.
故答案为:碳酸钠、硫酸.
故答案为:MnSO4.
(2)由工艺流程可知,MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全;
故答案为:增大溶液的pH,使Fe3+和 Al3+生成沉淀;
(3)依据电解原理分析,IV中电解的阳极反应为锰离子失电子生成二氧化锰,结合电荷守恒书写得到阳极反应式为:Mn2++2H2O-2e-=MnO2+4H+;
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
(4)操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用,电解IV分离出的产物C的化学式是H2SO4;
故答案为:H2SO4;
(5)生产中除得到MnO2和Zn以外,还可得到的副产品有Na2SO4、Fe2O3,根据流程图可知,副产物有硫、氧化铝.
故答案为:Al2O3、S;
(6)根据流程图可知,需要加入碳酸钠、硫酸,所以除矿石外,需购买的化工原料是碳酸钠、硫酸.
故答案为:碳酸钠、硫酸.
点评:本实验的目的是制备二氧化锰与锌,因而需要把氧化铝、铁元素、硫元素除去.据此考查学生对工艺流程的理解、物质性质、氧化还原反应、分离提纯基本操作、化学计算等,难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列说法不正确的( )
A、一种镁电池的反应式为XMg+Mo3S4
| |||
| B、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3?H2O | |||
| C、在甲、乙两个体积不变且相同的密闭容器中发生反应A(g)+2B(g)?2C(g),初始条件均为:常温,A、B两气体各1mol.甲容器中的反应在常温下达平衡,此时气体压强为原来气体压强的80%,乙容器中的反应在200℃时达平衡,若此时气体A的体积分数为35% 则说明该反应是放热反应 | |||
| D、已知:N2(g)+2O2(g)=2NO2(g)△H=+68 kJ?mol-12C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1C(s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-1则4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200 kJ?mol-1 |
下列电离方程式中,书写正确的是( )
| A、Na2SO4=2Na++SO4-2 |
| B、Ba(OH)2=Ba2++(OH-)2 |
| C、KClO3=K++Cl-+3O2- |
| D、Fe2(SO4)3=2Fe3++3SO42- |
化学与社会、环境等密切相关,下列有关说法中不正确的是( )
| A、利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 |
| B、单质硅是将太阳能转化为电能的常用材料 |
| C、PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 |
| D、“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式.利用CO2合成聚碳酸酯类可降低塑料的做法符合“低碳经济”的要求 |

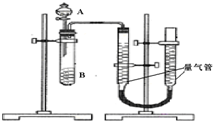 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):