题目内容
 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:(1)基态锗原子的价电子排布式为
(2)沸点:NH3
(3)某砷的氧化物俗称“砒霜”,其分子结构如图甲所示,该化合物的分子式为
(4)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为
考点:同一主族内元素性质递变规律与原子结构的关系,原子核外电子排布,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)锗为32号元素,根据能量最低原理书写电子排布式;
(2)根据分子间能形成氢键的沸点高判断;
(3)根据图中原子形成的共价键数判断属于哪种元素,再根据原子数写化学式;根据δ键电子对数和对孤电子对数判断As的杂化方式;
(4)根据分子中化合价对电子偏向的影响分析;
(5)已知反应物和部分生成物根据原子守恒书写;先求出一个晶胞中砷元素的质量,再根据晶胞的体积求算.
(2)根据分子间能形成氢键的沸点高判断;
(3)根据图中原子形成的共价键数判断属于哪种元素,再根据原子数写化学式;根据δ键电子对数和对孤电子对数判断As的杂化方式;
(4)根据分子中化合价对电子偏向的影响分析;
(5)已知反应物和部分生成物根据原子守恒书写;先求出一个晶胞中砷元素的质量,再根据晶胞的体积求算.
解答:
解:(1)锗为32号元素,原子核外有32个电子,其核外电子排布式为1s22s22p63s23p63d104s24p2;
故答案为:1s22s22p63s23p63d104s24p2;
(2)N原子的非金属性较强,NH3分子间能形成氢键沸点高,所以NH3的沸点大于AsH3的沸点;
故答案为:>;NH3分子间能形成氢键;
(3)氧原子能形成2个共价键,As形成3个共价键,由图可知分子中O原子数为6,As原子数为4,所以其化学式为As4O6;As最外层有5个电子,形成3个共价键即δ键电子对数为3,另外还有1个孤电子对,所以As的杂化方式为sp3;
故答案为:As4O6;sp3;
(4)H2SeO4和H3SeO3可表示为(HO)2SeO2和(HO)3Se,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+,所以H2SeO4比H2SeO3酸性强;
故答案为:H2SeO4和H3SeO3可表示为(HO)2SeO2和(HO)3Se,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+;
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为:(CH3)3Ga+AsH3
GaAs+3CH4;
由砷化镓的晶胞结构图可知一个晶胞中含有4个As原子,一个晶胞中砷元素的质量为
=
g,晶胞的体积为(a×10-10)3cm3,则每立方厘米该晶体中所含砷元素的质量为
=
g.
故答案为:(CH3)3Ga+AsH3
GaAs+3CH4;
.
故答案为:1s22s22p63s23p63d104s24p2;
(2)N原子的非金属性较强,NH3分子间能形成氢键沸点高,所以NH3的沸点大于AsH3的沸点;
故答案为:>;NH3分子间能形成氢键;
(3)氧原子能形成2个共价键,As形成3个共价键,由图可知分子中O原子数为6,As原子数为4,所以其化学式为As4O6;As最外层有5个电子,形成3个共价键即δ键电子对数为3,另外还有1个孤电子对,所以As的杂化方式为sp3;
故答案为:As4O6;sp3;
(4)H2SeO4和H3SeO3可表示为(HO)2SeO2和(HO)3Se,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+,所以H2SeO4比H2SeO3酸性强;
故答案为:H2SeO4和H3SeO3可表示为(HO)2SeO2和(HO)3Se,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,导致Se-O-H中的O的电子更向Se偏移,越易电离出H+;
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式为:(CH3)3Ga+AsH3
| ||
由砷化镓的晶胞结构图可知一个晶胞中含有4个As原子,一个晶胞中砷元素的质量为
| 75×4 |
| NA |
| 200 |
| NA |
| ||
| (a×10-10)3 |
| 3×10-32 |
| NAa3 |
故答案为:(CH3)3Ga+AsH3
| ||
| 3×10-32 |
| NAa3 |
点评:本题考查较为综合,涉及元素周期律的递变规律、杂化类型的判断、电子排布式以及氢键等知识,题目难度较大,本题的易错点为晶胞的有关计算,注意有关知识的积累.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
将一定量的甲烷燃烧后得到CO、CO2和水蒸气,混和气体的质量是49.6g通过无水氯化钙时,无水氯化钙增重25.2g,则CO2的质量是( )
| A、12.5g |
| B、13.2g |
| C、19.7g |
| D、24.4g |
下列实验能达到目的是( )
A、 用酒精萃取溴水中的溴 |
B、 将硫酸铜溶液直接蒸干得到胆矾 |
C、 说明2NO2(g)?N2O4(g)△H<0 |
D、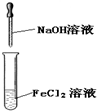 实验室制备Fe(OH)2 |
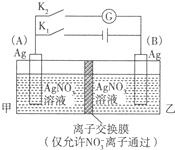 利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )
利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )| A、闭合K1,断开K2后,A电极增重 |
| B、闭合K1,断开K2后,乙池溶液浓度上升 |
| C、断开K1,闭合K2后,NO3-向B电极移动 |
| D、断开K1,闭合K2后,A电极发生氧化反应 |
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.该法的工艺流程为:CrO42-
Cr2O72-
Cr3+
Cr(OH)3↓,其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,下列说法错误的是( )
| H+ | ||
|
| Fe2+ | ||
|
| OH- | ||
|
| A、在第①反应平衡体系中加入水,溶液中c(H+)增大 |
| B、溶液的pH值不变时,说明第①步反应达平衡状态 |
| C、第②步中,还原0.01mol Cr2O72-离子,需要0.06mol的FeSO4?7H2O |
| D、上述三步转化反应中,只有一个反应为氧化还原反应 |
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.