题目内容
8.实验测得某碳氢化合物A中,含碳80%、含氢20%,求:(1)该化合物的实验式.
(2)若测得该化合物的相对分子质量是30,该化合物的分子式.
分析 由元素的含量可确定原子个数的比值,进而确定实验式,结合相对分子质量可确定有机物分子式,以此解答该题.
解答 解:(1)n(C):n(H)=$\frac{80%}{12}$:$\frac{20%}{1}$=1:3,则实验式为CH3,
答:该化合物的实验式为CH3;
(2)该化合物的相对分子质量是30,设分子式为(CH3)n,则15n=30,n=2,则分子式为C2H6,
答:该化合物的分子式为C2H6.
点评 本题考查有机物分子式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握有机物的分子式的确定方法,难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
19.除去下列物质中所含的杂质(括号内为杂质),选用试剂正确的是( )
| A. | Al2O3(SiO2):NaOH溶液 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | NaHCO3溶液(Na2CO3溶液):Ca(OH)2溶液 | D. | FeCl2溶液(FeCl3):Fe粉 |
16.下列有关实验的选项正确的是( )
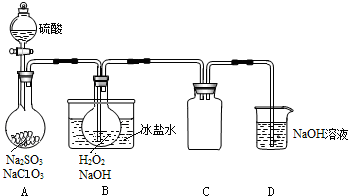
| A. | 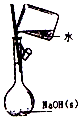 配制0.10mol/L NaOH溶液 | |
| B. | 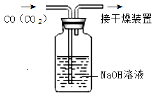 除去CO中的CO2 | |
| C. | 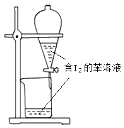 苯萃取碘水中的I2分出水层后的操作 | |
| D. |  除去粗盐溶液中的不溶物 |
3.下列说法正确的是( )
| A. | 减小反应物浓度,可减小单位体积内活化分子的百分数,从而使有效碰撞次数减少 | |
| B. | 对于有气体参加的化学反应,若减小压强(即扩大反应容器的体积),可减小活化分子的百分数,从而使反应速率减小 | |
| C. | 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率 | |
| D. | 能量高的分子一定能发生有效碰撞 |
13.下列实验装置、操作不能达到实验目的是( )
| A. |  测定中和热 | B. |  电解食盐水 | ||
| C. |  温度对化学平衡的影响 | D. |  催化剂对反应速率的影响 |
1.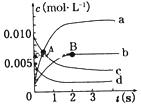 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO) 随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO) 随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$,已知:K(300℃)>K(350℃),该反应是放热反应(填“放热”或“吸热”);
(2)图中表示NO2的变化的曲线是b,用O2的浓度变化表示从0~2s内该反应的平均速率υ=1.5×10-3mol•L-1•s-1;
(3)能说明该反应已经达到平衡状态的是bc
a. υ(NO2)=2υ(O2) b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(5)若将容器体积缩小至1L,反应达到平衡时的平衡常数不变(填“增大”、“减小”或“不变”).
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO) 随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO) 随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b,用O2的浓度变化表示从0~2s内该反应的平均速率υ=1.5×10-3mol•L-1•s-1;
(3)能说明该反应已经达到平衡状态的是bc
a. υ(NO2)=2υ(O2) b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(5)若将容器体积缩小至1L,反应达到平衡时的平衡常数不变(填“增大”、“减小”或“不变”).