题目内容
3.某学生为测定未知浓度的稀硫酸溶液,实验如下:以0.14mol•L-1的NaOH溶液滴定上述稀H2SO425.00mL,滴定终止时消耗NaOH溶液15.00mL,该学生用标准0.14mol•L-1NaOH溶液滴定硫酸的实验操作如下:a检查滴定管是否漏水b取一定体积的待测液于锥形瓶中c用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管d装标准溶液和待测液并调整液面(记录初读数)e用蒸馏水洗涤玻璃仪器f把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度①滴定操作的正确顺序是aecdbf(用序号填写);
②碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果偏大(填“偏小”、“偏大”或“无影响”);观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值偏小(选填“偏大”“偏小”或“无影响”)
分析 ①中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,以此判断;
②碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小;观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小.
解答 解:①中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,所以滴定操作的正确顺序是aecdbf,
故答案为:aecdbf;
②碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小,滴定时消耗的氢氧化钠的体积偏大,所以计算结果偏大,
观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小,所以测定的硫酸的浓度偏小,
故答案为:偏大;偏小.
点评 本题考查了酸碱中和滴定,为高频考点,侧重于学生的分析能力和实验能力的熬成,题目难度中等,涉及了实验步骤、滴定方法、误差分析等知识,注意掌握误差分析的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.对下列物质的化学用语书写正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: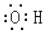 | ||
| C. | 苯酚的结构简式为C6H5OH | D. | 乙醇的分子式:CH3CH2OH |
12.从能量的变化和反应的快慢等角度研究反应具有重要意义.
(1)已知反应2H2+O2=H2O为放热反应,如图能正确表示该反应中能量变化的是A.
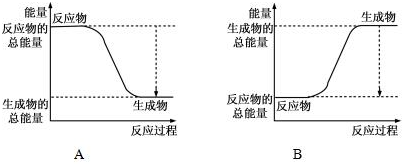
从断键和成键的角度分析上述反应中能量的变化.
化学键的键能如表:则生成1mol水可以放出热量242kJ
(2)原电池可将化学能转化为电能.将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是Zn,正极的反应式为Cu2++2e-=Cu,电解质溶液中SO42- 移向负极(填“正”或“负”).一段时间后,取出洗净、干燥、称量,二者质量差为12.9g.则导线中通过的电子的物质的量是0.2mol.
(3)一定温度下,将3molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为0.2mol/(L•min);X为2.若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于,小于或等于”).
(1)已知反应2H2+O2=H2O为放热反应,如图能正确表示该反应中能量变化的是A.

从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)原电池可将化学能转化为电能.将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是Zn,正极的反应式为Cu2++2e-=Cu,电解质溶液中SO42- 移向负极(填“正”或“负”).一段时间后,取出洗净、干燥、称量,二者质量差为12.9g.则导线中通过的电子的物质的量是0.2mol.
(3)一定温度下,将3molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为0.2mol/(L•min);X为2.若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于,小于或等于”).
 (1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.
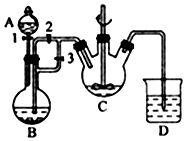
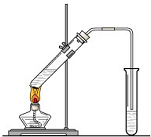 实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:
实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题: