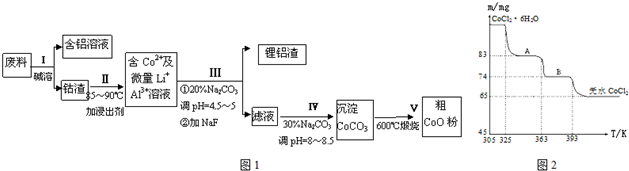
��Ŀ����
19��Ϊ̽����ϩ����ļӳɷ�Ӧ��ijС��ͬѧ��Ũ������Ҵ���ȡ������ͨ����ˮ�У�������Һ��ɫ����ͬѧ��Ϊ��ϩ����ˮ�����˼ӳɷ�Ӧ����ͬѧ������ɫ�����Һ������������ӣ��Ʋ����Ƶõ���ϩ�л�������������ԭ���������ʣ��ɴ�����������ȳ�ȥ���ʣ�������ˮ��Ӧ����ش���1����ͬѧ��Ϊ��ˮ��ɫ����Ҫ����ʽΪCH2=CH2+Br2��CH2BrCH2Br��
��2����С��ͬѧ��Ƶ�ʵ�鲻�ܣ���ܡ����ܡ�����֤��ϩ����ˮ�����ӳɷ�Ӧ��������A��C��
A��ʹ��ˮ��ɫ��Ӧδ���Ǽӳɷ�ӦB��ʹ��ˮ��ɫ��Ӧ���Ǽӳɷ�Ӧ
C��ʹ��ˮ��ɫ������δ������ϩD��ʹ��ˮ��ɫ�����ʾ�����ϩ
��3����ͬѧ�Ʋ���ϩ�бض����е�һ��������SO2��������Ʒ����Һ����֤��SO2����ˮ��Ӧ�Ļ�ѧ����ʽ��SO2+Br2+2H2O=H2SO4+2HBr��
��4��Ϊ��֤��һ��Ӧ�Ǽӳɶ�����ȡ������ͬѧ�������pH��ֽ�����Է�Ӧ����Һ�����ԣ�������������ȡ����Ӧ�������������ᣬ��Һ������������ǿ���ʿ���pH��ֽ��֤��
���� ��1����ͬѧ��Ϊ��ϩ����ˮ�����˼ӳɷ�Ӧ������ϩ����ˮ�ӳ�����1��2-�������飻
��2���Ҵ���Ũ������ԭ����ȡ����ϩ�к��ж�����������ʣ�����������ʹ��ˮ��ɫ����ˮ��ɫ����֤������ϩ����ˮ�����˼ӳɷ�Ӧ��
��3�������������Ư���ԣ��ܹ�ʹƷ����Һ��ɫ��ͨ����Ʒ������������Ĵ��ڣ�����������л�ԭ�ԣ��ܹ�����ˮ����������ԭ��Ӧ����������������
��4��������ϩ���巢����ȡ����Ӧ����������Ӧ��������жϣ�
��� �⣺��1����ͬѧ��Ϊ��ϩ����ˮ�����˼ӳɷ�Ӧ������ϩ����ˮ�ӳ�����1��2-�������飬��ѧ����ʽ��CH2=CH2+Br2��CH2BrCH2Br��
�ʴ�Ϊ��CH2=CH2+Br2��CH2BrCH2Br��
��2���ô˷��õ�����ϩ�ڿ��ܺ���SO2���壬��SO2�ܽ���ˮ��ԭ��ʹ֮��ɫ������ʽΪSO2+Br2+2H2O�T2HBr+H2SO4����ˮ��ɫ����֤������ϩ����ˮ�����˼ӳɷ�Ӧ�ˣ�
�ʴ�Ϊ�����ܣ�AC��
��3�������������Ư���ԣ��ܹ�ʹƷ����Һ��ɫ��ͨ����Ʒ������������Ĵ��ڣ�����������л�ԭ�ԣ��ܹ�����ˮ����������ԭ��Ӧ����������������ᣬ��ѧ����ʽ��SO2+Br2+2H2O=H2SO4+2HBr��
�ʴ�Ϊ��Ʒ����Һ��SO2+Br2+2H2O=H2SO4+2HBr��
��4��ϩ����ķ�Ӧ�У�������ȡ����Ӧ���ض�����HBr����Һ���Խ���������ǿ���ʿ���pH��ֽ��֤����һ��Ӧ�Ǽӳɷ�Ӧ������ȡ����Ӧ��
�ʴ�Ϊ��������ȡ����Ӧ�������������ᣬ��Һ������������ǿ���ʿ���pH��ֽ��֤��
���� ���⿼������ϩ���巴Ӧԭ��̽������ȷ��ϩ�Ľṹ�������ǽ���ؼ���ע��ʵ����������ԣ���Ŀ�ѶȲ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
| A�� | K��HF��=7.2��10-4 | B�� | K��HNO2��=4.9��10-10 | ||
| C�� | ��ӦNaCN+HF�THCN+NaF���Է��� | D�� | K��HCN����K��HNO2����K��HF�� |

| A�� | ��ʾ 2molH2 ��g����ȫȼ������ˮ��������241.8 kJ���� | |
| B�� | ��ʾ���Ȼ�ѧ����ʽΪ��H2��g��+$\frac{1}{2}$02��g���TH20��g����H=-241.8 kJ/mol | |
| C�� | ��ʾ2mol H2��g�������е�����һ����2 mol��̬ˮ�����е�������483.6 kJ | |
| D�� | H20��g������������H2��g����O2��g��������֮�� |
| A�� | SO3 | B�� | CO2 | C�� | Na2O2 | D�� | Na |
| A�� | ��Һ�ͽ���ı��������Ƿ��ж����ЧӦ | |
| B�� | ��pH��ֽ�ⶨij������ˮ��pHΪ4 | |
| C�� | ���������ﲻһ��������ˮ��Ӧ�����ᣬ���������ﲻһ���Ǽ��������� | |
| D�� | ����SO2��CO2����ֱ�ͨ��BaCl2��Һ�о��а�ɫ�������� |
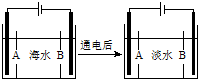 ����ijС���ϣ������õĵ�ˮ��Դ�൱�ѷ�����ž�սʿΪ��Ѱ�Һ��ʵ�����ˮԴ���Ե���ɽȪˮ���з������飮
����ijС���ϣ������õĵ�ˮ��Դ�൱�ѷ�����ž�սʿΪ��Ѱ�Һ��ʵ�����ˮԴ���Ե���ɽȪˮ���з������飮