题目内容
19.下列反应的离子方程式中正确的是( )| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 氢氧化钡溶液与稀硫酸混合:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ |
分析 A.电荷不守恒;
B.生成硫酸钡和水,不符合离子的配比;
C.碳酸钙不溶于水,写成化学式;
D.石灰乳写成化学式.
解答 解:A.电荷不守恒,应为Cu+2Ag+═Cu2++2Ag,故A错误;
B.生成硫酸钡和水,不符合离子的配比,离子反应应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B错误;
C.碳酸钙不溶于水,写成化学式,离子方程式为CaCO3+2H+═Ca2++H2O+CO2↑,故C正确;
D.石灰乳写成化学式,离子方程式为CO32-+Ca(OH)2═CaCO3↓+2OH-,故D错误.
故选C.
点评 本题考查离子方程式正误判断,为高频考点,明确离子反应实质、离子性质是解本题关键,知道哪些物质写化学式、哪些物质写离子,易错选项是D,注意石灰乳与澄清石灰水的区别.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | 固态氯化钠不导电,所以NaCl是非电解质 | |
| B. | 氨气的水溶液能导电,所以氨气是电解质 | |
| C. | SO3溶于水能导电,是因为SO3在水中发生了电离 | |
| D. | 液态氯化氢不导电,但是HCl是电解质 |
14.38.4g铜跟适量的浓HNO3反应,铜全部作用后,共收集到气体22.4L(标准状况下),反应消耗的HNO3的物质的量可能是( )
| A. | 1.0mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
4.某溶液能使PH试纸变红,在此溶液中能大量共存的离子是( )
| A. | Ca2+、K+、Cl-、SO32- | B. | NH4+、Fe2+、I一、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
9.阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为:2H2+O2═2H2O,电解液为KOH,反应保持在较高温度,使H2O蒸发,下列叙述正确的是( )
| A. | 电池能发出蓝色火焰 | B. | H2为正极,O2为负极 | ||
| C. | 正极反应为:O2+2H2O+4e-═4OH- | D. | 正极反应为:2H2+4OH--4e-═4H2O |
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
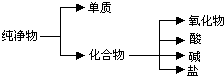 (1)纯净物根据其组成和性质可进行如图分类:
(1)纯净物根据其组成和性质可进行如图分类: