题目内容
10. 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )| A. | 常温下,0.1mol•L-1氨水的电离常数K约为1×10-5mol•L-1 | |
| B. | a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | c点溶液中c(NH4+)=c(Cl-) | |
| D. | d点代表两溶液恰好完全反应 |
分析 A.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,结合Ka=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算;
B.a、b之间的任意一点,溶液都呈碱性,结合电荷守恒判断离子浓度大小;
C.根据图知,c点c(H+)>10-7mol/L,c(OH-)<10-7mol/L,溶液呈酸性,结合电荷守恒判断c(NH4+)、c(Cl-)相对大小;
D.两溶液恰好完全反应生成氯化铵,溶液应该为酸性,而d点溶液为中性.
解答 解:A.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,Ka=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$mol/L=1×10-5mol/L,故A正确;
B.a、b之间的任意一点,溶液都呈碱性,则c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH4+),故B错误;
C.根据图知,c点c(H+)>10-7mol/L,c(OH-)<10-7mol/L,溶液呈酸性,结合电荷守恒得:c(NH4+)<c(Cl-),故C错误;
D.d点溶液中c(H+)=10-7mol/L,常温下c(H+).c(OH-)=Kw=10-14,所以c(H+)=c(OH-),溶液呈中性,如果氨水和盐酸恰好完全反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,故D错误;
故选A.
点评 本题考查溶液酸碱性与溶液pH的关系,为高频考点,侧重考查学生分析判断及识图能力,明确图中曲线变化趋势及每一点溶液中溶质成分及其性质是解本题关键,注意电荷守恒的灵活运用,题目难度中等.

 字词句段篇系列答案
字词句段篇系列答案| A. | SiO2→Na2SiO3 | B. | SiO 2→H 2SiO 3 | C. | CuSO 4→CuCl 2 | D. | Cu(OH)2→CuO |
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯酚能跟NaOH溶液反应,而乙醇不能与NaOH溶液反应 | |
| C. | 苯与硝酸在加热的条件生成硝基苯,而甲苯在加热条件下与硝酸发生反应生成三硝基甲苯 | |
| D. | 乙炔能发生加成,乙烷不能 |
| A. | CuO→Cu2O | B. | H2SiO3→SiO2 | C. | Cu→Cu2(OH)2CO3 | D. | Cu→Cu(OH)2 |
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的△H=2×(-57.3)kJ•mol-1 |
| A. | 从溶解的整个过程来看,既包含着物理变化,又包含着化学变化 | |
| B. | 氯化钠溶于水达到饱和后,溶解过程并没有停止 | |
| C. | 氯化钠溶于水中,无论是否形成饱和溶液,都存在溶解与结晶的过程 | |
| D. | 将K37Cl投入到K35Cl的饱和溶液中,溶液中溶质的质量会减小 |
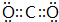 ,BA2分子中化学键属于共价键.
,BA2分子中化学键属于共价键.