题目内容
16.下列说法正确的是( )| A. | 用直接加热并蒸干FeCl3溶液的方法可制得纯净的无水FeCl3 | |
| B. | 等物质的量浓度的Na2CO3溶液和CH3COONa溶液的pH,前者大于后者 | |
| C. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,消耗NaOH的物质的量不相等 | |
| D. | 对于有气体参加的反应,增大气体反应物浓度,活化分子百分数增大,反应速率加快 |
分析 A.三氯化铁在溶液中存在水解平衡,从平衡移动的角度分析蒸干溶液得到水解产物;
B.碳酸根离子水解程度大于醋酸根离子溶液碱性强;
C.中和等体积、等物质的量浓度的盐酸和醋酸溶液,消耗NaOH的物质的量不相等;
D.增大压强、浓度,单位体积活化分子的数目增多,活化分子的百分数不变;
解答 解:A.在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,故A错误;
B.碳酸根离子水解程度大于醋酸根离子溶液碱性强,等物质的量浓度的Na2CO3溶液和CH3COONa溶液的pH,前者大于后者,故B正确;
C.等体积、等物质的量浓度的盐酸和醋酸溶液,溶质物质的量相同,与氢氧化钠反应,分别发送生HCl+NaOH=NaCl+H2O,CH3COOH+NaOH=CH3COONa+H2O,即中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需氢氧化钠相同,故C错误;
D.增大体系压强只增大单位体积活化分子的数目,反应速率加快,百分数不变,故D错误;
故选B.
点评 本题考查盐类的水解、酸碱反应特征分析,酸碱中和反应,恰好中和是按照化学方程式的定量计算关系判断,题目难度中等,注意水解平衡移动的影响因素.

练习册系列答案
相关题目
11.下列物质中,既能够导电又属于电解质的是( )
| A. | 固体氯化钠 | B. | 熔融氯化镁 | C. | 氯化氢气体 | D. | 氨水 |
7.下列物质在稀硫酸作用下发生水解反应只生成一种产物的是( )
| A. | 蔗糖 | B. | 麦芽糖 | C. | 油脂 | D. | 蛋白质 |
4.杀鼠灵是一种抗凝血性杀毒剂,其结构简式如图,下列说法正确的是( )
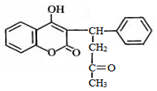

| A. | 分子中有1个手性碳原子 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 1mol杀鼠灵最多能与9molH2反应 | D. | 能发生加成、取代、氧化反应 |
11.运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应5KC1O3+6P=3P2O5+5KC1.下列有关该反应的叙述错误的是( )
| A. | KC1O3是氧化剂 | |
| B. | P2O5是氧化产物 | |
| C. | 1 mol KC1O3参加反应有6 mol e-转移 | |
| D. | 每有6 mol P被还原,生成5 mol KCl |
1.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水电离出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
8.下列实验方法能达到实验目的是( )
| A. | 用铂丝蘸取某未知溶液于酒精灯火焰上灼烧,火焰显黄色,证明该溶液中不含K+ | |
| B. | 向某未知溶液中先滴加氯水,再滴加KSCN溶液,出现血红色,证明溶液中含有Fe2+ | |
| C. | 萃取碘水中的碘时,可以选择苯或四氧化碳作为萃取剂 | |
| D. | 某无色溶液中加入硝酸银溶液后产生白色沉淀,再加入稀盐酸沉淀不消失,证明原溶液中含有Cl- |
5.2015年8月12日天津塘沽爆炸的主要原因系仓库内金属钠遇水发生反应引发爆炸.下列有关说法错误的是( )
| A. | 金属钠和水反应放热 | B. | 金属钠和水反应产生可燃烧的氢气 | ||
| C. | 可在现场使用干沙灭火 | D. | 可在现场使用高压水枪灭火 |
5.1molSO2气体、1molSO2液体、1molSO2固体中,它们所含的分子数是( )
| A. | 气体最多 | B. | 液体比气体多 | C. | 固体最多 | D. | 以上都不对 |