题目内容
18.将少量铝粉加入某溶液中有氢气放出,则该溶液中一定能大量共存的离子组是( )| A. | K-、Ba2+、NO3-、SO32- | B. | NH4+、Al3+、Cl-、SO42- | ||
| C. | K Na2+[Al(OH)4]-、SO42- | D. | Na+、K+、SO42-、Br- |
分析 将少量铝粉加入某溶液中有氢气放出,该溶液中存在大量氢离子或氢氧根离子,
A.钡离子与亚硫酸根离子反应生成亚硫酸钡沉淀;
B.铵根离子、铝离子与氢氧根离子反应;
C.[Al(OH)4]-与氢离子反应;
D.四种离子之间不反应,都不与氢离子、氢氧根离子反应.
解答 解:将少量铝粉加入某溶液中有氢气放出,该溶液中存在大量氢离子或氢氧根离子,
A.Ba2+、SO32-之间反应生成亚硫酸钡,在溶液中不能大量共存,故A错误;
B.NH4+、Al3+与氢氧根离子反应,在碱性溶液中不能大量共存,故B错误;
C.[Al(OH)4]-与氢离子发生反应,在酸性溶液中不能大量共存,故C错误;
D.Na+、K+、SO42-、Br-之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
19.下列电子式书写错误的是( )
| A. |  | B. |  | C. |  | D. |  |
6.下列离子方程式错误的是( )
| A. | 氨气通入稀硫酸 NH3+H+═NH4+ | |
| B. | 稀烧碱溶液和氯化铵溶液混合 NH4++OH-═NH3•H2O | |
| C. | 碳酸氢铵和足量浓烧碱溶液混合加热 NH4++OH-═NH3↑+H2O | |
| D. | Cl2和水反应 Cl2+H2O═H++Cl-+HClO |
13.在恒温、恒容的条件下,可逆反应H2(g)+I2(g)?2HI(g) 达到化学平衡状态的标志是( )
| A. | 混合气体的压强不再变化 | B. | 混合气体的密度不再变化 | ||
| C. | 混合气体的颜色不再变化 | D. | 混合气体中c(H2):c(I2):c(HI)=1:1:2 |
3.白磷分子(P4)为正四面体构型,其中P原子的杂化形式为( )
| A. | sp3 | B. | sp2 | C. | sp | D. | 不确定 |
7.下列关于金属性、非金属性强弱判断不正确的是( )
| A. | 高温下C+SiO2=2CO+Si,说明非金属性C>Si | |
| B. | 同浓度下碱性:KOH>Mg(OH)2,说明金属性K>Mg | |
| C. | 氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性F>Cl | |
| D. | 氧化性:Cu2+>Na+,说明金属性Na>Cu |
8.已知柠檬醛的结构简式为(CH3)2C=CHCH2CH2CH=C(CH3)CHO.根据学过的知识判断下列说法不正确的是( )
| A. | 它可使酸性高锰酸钾溶液褪色 | B. | 它能使溴水褪色 | ||
| C. | 它可与银氨溶液反应 | D. | 若催化加氢,最终产物是 C10H20O |
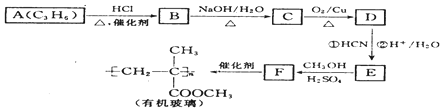
 $→_{②H+/H_{2}O}^{①HCN}$
$→_{②H+/H_{2}O}^{①HCN}$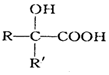 (注:R′可以是H原子)
(注:R′可以是H原子) 是一种生物可降解材料,请参考上述信息设计由乙醇制备聚乳酸的合成路线
是一种生物可降解材料,请参考上述信息设计由乙醇制备聚乳酸的合成路线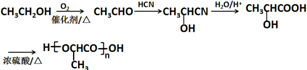 .合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
.合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.