题目内容
3.下列图象不正确的是( )| A. |  向100mL 0.1mol•L-1H2SO4溶液中滴加0.1mol•L-1Ba(OH)2溶液至过量 | |
| B. | 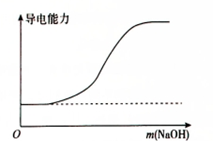 向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体 | |
| C. |  向一定浓度的氯化钠溶液中加水 | |
| D. |  向蒸馏水中通入HCl气体 |
分析 溶液的导电能力与离子的浓度成正比,离子浓度越大导电能力越强,浓度越小导电能力越弱,如果能增大溶液中离子浓度,则能增大溶液的导电能力,否则不能增大溶液的导电能力,据此分析解答.
解答 解:A.向100mL 0.1mol•L-1H2SO4溶液中滴加0.1mol•L-1Ba(OH)2溶液至过量,发生反应为:H2SO4+Ba(OH)2=BaSO4↓+2H2O,所以溶液中离子浓度先减小到接近0,后来Ba(OH)2溶液过量,离子浓度又增大,但最终过量的Ba(OH)2溶液中离子浓度小于开始的0.1mol•L-1H2SO4溶液,所以溶液的导电能力先减小到0后增大,但小于开始,故A错误;
B.向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体,发生反应为:H2SO4+2NaOH=Na2SO4+2H2O,则开始离子浓度不变,NaOH固体过量时离子浓度才增大,所以溶液的导电能力开始不变后来增大,故B正确;
C.向一定浓度的氯化钠溶液中加水,溶液中离子浓度不断减小,所以溶液的导电能力不断减小,但不等于0,故C正确;
D.向蒸馏水中通入HCl气体,溶液中离子浓度不断增大,直到达到饱和溶液,浓度不变,所以导电能力先不断增大,后不变,故D正确;
故选A.
点评 本题考查了溶液导电能力的变化判断,注意溶液的导电能力与离子浓度成正比,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列关于有机化合物的说法正确的是( )
| A. | 可用饱和碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| B. | 苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色 | |
| C. | 淀粉和纤维素不是同分异构体,但它们水解的最终产物是同分异构体 | |
| D. | 甲烷和氯气按体积比1:2的比例混合后光照,生成的有机物全部是CH2Cl2 |
11.下列物质存放方法不正确的是( )
| A. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| B. | 金属钠存放于煤油中 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 漂白粉长期敞口放置在烧杯中 |
18.下列有关电解质溶液的说法不正确的是( )
| A. | pH=10的NaOH溶液和pH=4的醋溶液等体积混合后溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$<1 | |
| B. | 向Ba(OH)2和氨水的混合溶液中滴加盐酸时$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$减小 | |
| C. | Na2CO3溶液中通入CO2,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$保持不变 | |
| D. | HClO溶液稀释为原来体积的100倍,$\frac{c(Cl{O}^{-})}{c(HClO)}$增大 |
8.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol Cu与足量稀硝酸反应产生NA个NO分子 | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L-1 | |
| C. | 通常条件下,7.1g 37Cl2含中子数为4.0NA | |
| D. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.2NA |
15.下列有关实验操作的说法正确的是( )
| A. | 可用10mL量筒量取5.00mL KMnO4溶夜 | |
| B. | 用瓷坩埚灼烧氢氧化钠、碳酸钠 | |
| C. | 蒸馏时蒸馏烧瓶中液体的体积不能超过其容积的$\frac{2}{3}$,液体也不能蒸干 | |
| D. | 把粉未状氢氧化钠固体直接放在天平的托盘中称量,其质量为7.4g |
7.下列说法正确的是( )
| A. | 1 mol任何气体的摩尔体积都约是22.4 L | |
| B. | 标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数 | |
| C. | 处于标准状况的两种气体,当体积均为22.4 L时的质量完全相同 | |
| D. | 标准状况时,2 mol任何物质的体积均约为44.8 L |





 ;⑥
;⑥ +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O. ;
; .
.