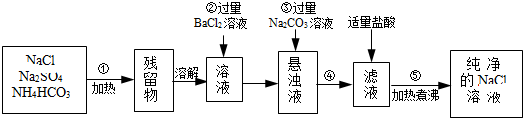
题目内容
20.下列说法正确的是( )| A. | 将混有HCl的Cl2通入盛有饱和NaHCO3溶液的洗气瓶除去 | |
| B. | 实验室制取Cl2,浓盐酸起到酸性和还原剂的作用 | |
| C. | 用惰性电极电解饱和食盐水的离子方程式为2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| D. | 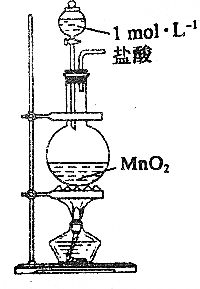 实验室可用图所示装置于制取少量Cl2 |
分析 A.氯气、氯化氢都能够与碳酸氢钠溶液反应;
B.依据实验室制备氯气实验原理;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,分析元素化合价变化判断氯化氢性质;
C.用惰性电极电解饱和食盐水生成氯气、氢气和氢氧化钠;
D.二氧化锰与浓盐酸反应,与稀盐酸不反应;
解答 解:A.将混有HCl的Cl2通入盛有饱和NaHCO3溶液,氯气、氯化氢都能与碳酸氢钠溶液反应被吸收,得到气体为二氧化碳,故A错误;
B.MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,则MnO2为氧化剂,Cl元素的部分化合价升高,部分化合价不变,则HCl表现还原性和酸性,故B正确;
C.用惰性电极电解饱和食盐水生成氯气、氢气和氢氧化钠,电离方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,故C错误;
D.1mol/L的盐酸为稀盐酸,与二氧化锰不反应,得不到氯气,故D错误;
故选:B.
点评 本题为综合题,考查了物质的分离提纯、氯气的实验室制备、氧化还原反应基本概念,明确除杂原则及方法选择、熟悉氯气制备原理是解题关键,题目难度中等.

练习册系列答案
相关题目
10.下列物质的命名正确的是( )
| A. | 3.4-二甲基戊烷 | B. | 3-甲基-4-已烯 | ||
| C. | 3.4-二甲基-2-戊烷 | D. | 3-丙基-2,4-戊二醇 |
11.下列有关环境问题的说法中正确的是( )
| A. | 煤、石油等化石燃料燃烧过程中排放的废气是形成酸雨的主要原因,酸雨指的是pH小于7的雨水 | |
| B. | 雾霾可能是许多细小液体和固体微粒分散到空气中形成的一种气溶胶 | |
| C. | 在煤中添加适量的石膏可减少燃烧过程中含硫化合物的排放从而减少污染 | |
| D. | 煤和石油都属于一级能源而天然气属于二级能源 |
8.萘的结构简式为 ,其二硝基取代物有( )
,其二硝基取代物有( )
 ,其二硝基取代物有( )
,其二硝基取代物有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
15.部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,进行如下处理:
下列说法正确的是( )

下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3、H+ | B. | 样品中金属Fe的质量为4.48g | ||
| C. | 样品中CuO的质量为4.0 | D. | V=448 |
8.下列物质的分类合理的是( )
| A. | 碱性氧化物:Na2O、CaO、Al2O3、H2O | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 氧化物:Fe2O3、NO、SO2、CuO | D. | 酸:H2SO4、HNO3、NaHSO4 |
6.下列关系正确的是( )
| A. | 水溶性:乙醇>新戊烷>苯酚 | |
| B. | 同质量的物质燃烧消耗O2量:乙烷>甲烷>乙炔 | |
| C. | 密度:水>苯>硝基苯 | |
| D. | 沸点:正戊烷>异戊烷>新戊烷 |