题目内容
2.为了探究AgNO3的氧化性,某化学兴趣小组设计了如下实验:将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、酸性高锰酸钾溶液、氯水、氢氧化钠溶液、双氧水.| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴KSCN溶液,振荡 | 溶液呈血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,振荡 | 产生蓝色沉淀 | 存在Fe2+ |
分析 依据铁离子与硫氰酸钾溶液反应生成血红色溶液验证铁离子的存在;亚铁离子的检验是K3[Fe(CN)6]溶液和亚铁离子结合生成蓝色沉淀.
解答 解:取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡,若含有铁离子溶液会变血红色,验证亚铁离子实验是取少量除尽Ag+后的溶液于试管中,加入K3[Fe(CN)6]溶液会和亚铁离子反应生成蓝色沉淀,证明含亚铁离子,
故答案为:
| 操作 | 现象 | 结论 |
| 溶液呈血红色 | ||
| K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
点评 本题考查离子的检验,注意实验设计的方法和物质实验验证方案分析判断,物质性质的应用是解题关键,题目难度中等.

练习册系列答案
相关题目
9.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4LC2H2、C2H6的混合气体与22.4LC2H4中所含原子总数均为6NA | |
| B. | 常温下,1L PH=14的NaOH溶液中由水电离出的OH-个数为NA | |
| C. | 标准状况下,11.2L的12C16O和14N2的混合气体中所含中子数和原子数的差值为6NA | |
| D. | 将200mL0.1mol•L-1FeCl3溶液制成胶体,所得Fe(OH)3胶体粒子数为0.02NA |
10.分子式为C7H6Cl2的芳香族化合物共有(不含立体异构体)( )
| A. | 6种 | B. | 9种 | C. | 10 种 | D. | 12 种 |
7.SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究.
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成.向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是SO2的水溶液中存在如下平衡SO2+H2O?H2SO3?H++HSO3-加入NaHSO3固体增加了c( HSO3-),平衡左移,降低了SO2的溶解度.(结合有关平衡方程式简要说明)
②欲验证酸性:H2SO3>HClO,选用图1的装置,其连接顺序为:A→C→B→E→D→F (按气流方向用大写字母表示即可).能证明H2SO3的酸性强于HClO的实验现象为D中品红不褪色,F中产生白色沉淀.
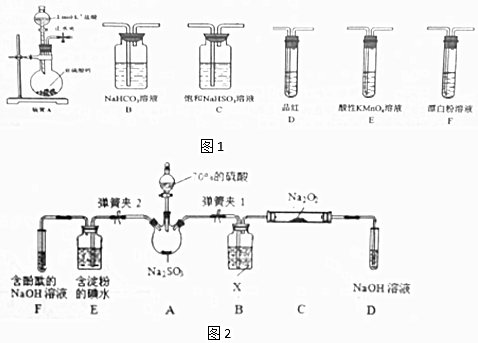
(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图2示装置进行实验.(部分固定装置未画出)
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成.向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是SO2的水溶液中存在如下平衡SO2+H2O?H2SO3?H++HSO3-加入NaHSO3固体增加了c( HSO3-),平衡左移,降低了SO2的溶解度.(结合有关平衡方程式简要说明)
②欲验证酸性:H2SO3>HClO,选用图1的装置,其连接顺序为:A→C→B→E→D→F (按气流方向用大写字母表示即可).能证明H2SO3的酸性强于HClO的实验现象为D中品红不褪色,F中产生白色沉淀.

(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图2示装置进行实验.(部分固定装置未画出)
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
14.A、B两种元素,A的原子序数为a,如果A和B同在第ⅣA族,当B的周期数大于A的周期数时,B的原子序数不可能为( )
| A. | a+2 | B. | a+8 | C. | a+26 | D. | a+18 |
7.NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
14.下列有关的判断或表示方法正确的是( )
| A. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1 | |
| B. | 中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验 | |
| C. | 在测定中和热的实验中,至少需要测定并记录的温度是3次 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
11.S(单斜)和S(正交)是硫的两种同素异形体已知:
①S(单斜,s)+O2(g)=SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)=SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)=S(正交,s)△H3
④S(正交,s)=S (g)△H4
⑤S(单斜,s)=S (g)△H5
下列说法正确的是( )
①S(单斜,s)+O2(g)=SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)=SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)=S(正交,s)△H3
④S(正交,s)=S (g)△H4
⑤S(单斜,s)=S (g)△H5
下列说法正确的是( )
| A. | 单斜硫转化为正交硫需要吸热 | B. | 单斜硫比正交硫稳定 | ||
| C. | △H4>△H5 | D. | △H4<0 |
12.下列关系互为同分异构体的是( )
| A. | 35 C1和37Cl | B. | CH3CH2CH2 CH3和CH (CH3)3 | ||
| C. | CH3CH3和CH3CH2CH3. | D. | H2O和H2O2 |