题目内容
16.NaCl、MgCl2、AlCl3三种溶液的体积比为3:2:1,分别与等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是( )| A. | 1:2:3 | B. | 3:4:3 | C. | 6:3:2 | D. | 4:3:4 |
分析 与等体积等物质的量浓度的AgNO3溶液恰好完全反应,说明等体积的NaCl、MgCl2、AlCl3三种溶液中氯离子的物质的量相等,然后根据NaCl、MgCl2、AlCl3三种溶液的体积比为3:2:1及c=$\frac{n}{V}$计算.
解答 解:与等体积等物质的量浓度的AgNO3溶液恰好完全反应,说明等体积的NaCl、MgCl2、AlCl3三种溶液氯离子的物质的量相等,设三种溶液中氯离子的浓度都为6mol,则NaCl、MgCl2、AlCl3三种溶液中溶质的物质的量分别是NaCl为6mol、MgCl2为3mol、AlCl3为2mol,
NaCl、MgCl2、AlCl3三种溶液的体积比为3:2:1,
则三种溶液的物质的量浓度之为:$\frac{6}{3}$:$\frac{3}{2}$:$\frac{2}{1}$=4:3:4,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
4.自然界中,金属硫化物矿床常因发生表生氧化及次生富集作用,产生辉铜矿(Cu2S)与铜蓝(CuS).
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将三份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如表所示:
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
(1)用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为35.2mL.(保留1位小数)
(2)甲实验结束后,溶液中c(NO3-)=2.75mol/L.
(3)混合物样品中Cu2S、CuS的物质的量之比是多少?(写出计算过程)
(4)乙实验结束后,溶液中氢离子的浓度是多少?(写出计算过程)
(5)计算丙实验中产生气体的体积(V).(写出计算过程)
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将三份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如表所示:
| 实验编号 | 甲 | 乙 | 丙 |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
(1)用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为35.2mL.(保留1位小数)
(2)甲实验结束后,溶液中c(NO3-)=2.75mol/L.
(3)混合物样品中Cu2S、CuS的物质的量之比是多少?(写出计算过程)
(4)乙实验结束后,溶液中氢离子的浓度是多少?(写出计算过程)
(5)计算丙实验中产生气体的体积(V).(写出计算过程)
8.关于C (s)+H2O (g)?CO (g)+H2(g)的平衡常数书写形式,正确的是( )
| A. | K=$\frac{[C]•[{H}_{2}O]}{[CO]•[{H}_{2}]}$ | B. | K=$\frac{[CO]•[{H}_{2}]}{[C]•[{H}_{2}O]}$ | C. | K=$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$ | D. | K=$\frac{[{H}_{2}O]}{[CO]•[{H}_{2}]}$ |
5.X、Y、Z、W都是短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X、Y、Z三种原子的最外层电子数之和为19.下列说法正确的是( )
| A. | Z元素的最高价氧化物对应的水化物酸性强于Y元素的最高价氧化物对应的水化物 | |
| B. | X、Y、Z形成的简单离子的半径大小:Yn->Zm->Xm- | |
| C. | 元素Z、Y分别与元素W形成的化合物的热稳定性:WmZ<WnY | |
| D. | 若HnY溶液的酸性比HmZ溶液的酸性强,则Y的非金属性比Z的强 |
6.为检验某卤代烃(R-X)中的X元素,有下列实验操作:①加热煮沸;②加入AgNO3溶液;③取少量卤代烃;④加入稀硝酸酸化;⑤加入NaOH溶液;⑥冷却.正确操作的先后顺序是( )
| A. | ③①⑤⑥②④ | B. | ③①②⑥④⑤ | C. | ③⑤①⑥④② | D. | ③⑤①⑥②④ |

 .
. .
. 的合成路线(无机原料任选).
的合成路线(无机原料任选).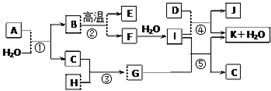 如图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出.已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法.
如图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出.已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法. ;I中所含化学键类型离子键、共价键.
;I中所含化学键类型离子键、共价键.