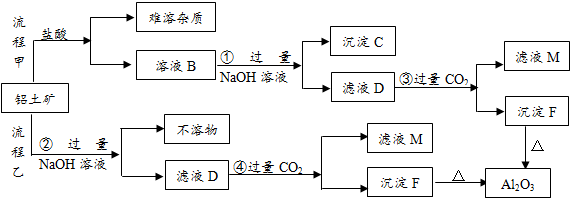
题目内容
7.用标准浓度的溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )①碱式滴定管用蒸馏水洗净后未用标准溶液润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③酸式滴定用蒸馏水洗净后,未用盐酸润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱试滴定管读数时,视线高于刻度线.
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ④⑤ |
分析 根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:①碱式滴定管用蒸馏水洗净后未用标准溶液润洗,标准溶液浓度减小,导致V(标准)偏大,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知c(待测)偏大,故①正确;
②锥形瓶中有少量蒸馏水,待测液的物质的量不变,则V(标准)不变,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知,c(待测)不变,故②错误;
③取未知浓度盐酸的酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗,待测液的物质的量偏小,导致V(标准)偏小,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知,c(待测)偏小,故③错误;
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失,导致V(标准)偏大,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知,c(待测)偏大,故④正确;
⑤滴定后观察碱试滴定管读数时,视线高于刻度线,导致V(标准)偏小,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知,c(待测)偏小,故⑤错误;
故选A.
点评 本题考查中和滴定的误差分析,题目难度中等,注意利用公式来分析解答,无论哪一种类型的误差,都可以归结为对标准溶液体积的影响,其标准溶液的体积偏小,物质的量的浓度也偏小;其标准溶液的体积偏大,物质的量的浓度也偏大.

练习册系列答案
相关题目
11.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 活泼非金属单质在氧化还原反应中只作氧化剂 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 含有某元素最高价态的化合物不一定具有强氧化性 |
12.下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+═Fe2++Cu
②SO42-+Ba2+═BaSO4↓
③Cl2+H2O═H++Cl-+HClO
④CO32-+2H+═CO2↑+H2O
⑤Ag++Cl-═AgCl↓
①Fe+Cu2+═Fe2++Cu
②SO42-+Ba2+═BaSO4↓
③Cl2+H2O═H++Cl-+HClO
④CO32-+2H+═CO2↑+H2O
⑤Ag++Cl-═AgCl↓
| A. | 只有③ | B. | ②③ | C. | ③⑤ | D. | ①④ |
16.NaCl、MgCl2、AlCl3三种溶液的体积比为3:2:1,分别与等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是( )
| A. | 1:2:3 | B. | 3:4:3 | C. | 6:3:2 | D. | 4:3:4 |
17.下列叙述正确的是( )
| A. | 在氧化还原反应中,失去电子的物质所含元素化合价降低 | |
| B. | 在一个氧化还原反应中,氧化剂和还原剂不可能是同一物质 | |
| C. | 氧化还原反应的本质是电子的转移(得失或偏移) | |
| D. | 在氧化还原反应中所有元素的化合价一定都发生变化 |

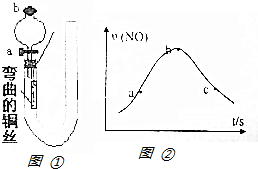 如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题:
如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题: