题目内容
20.高分子聚合物P的合成路线如图:
(1)写出反应所需试剂与条件.反应①氯气、光照;反应⑦氢氧化钠醇溶液、加热.
(2)写出反应类型.反应③消去反应;反应⑥加成反应.
(3)写出结构简式.EHOCH2CH=CHCH2OH;P
 .
.(4)设计反应⑥⑦的目的是保护碳碳双键,防止被氧化.
(5)写出符合下列要求的G的同分异构体的结构简式(不考虑立体结构)
 .
.Ⅰ.能发生银镜反应Ⅱ.只含两种化学环境不同的氢原子Ⅲ.不含-O-O-结构
(6)写出用A的一种同分异构体为原料合成
 的合成路线(无机原料任选).
的合成路线(无机原料任选).(合成路线的常用表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反映试剂}$目标产物).
分析 结合C的结构简式可知C7H8为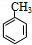 ,由转化关系可知,甲苯与氯气在光照条件下发生取代反应生成C7H7Cl为
,由转化关系可知,甲苯与氯气在光照条件下发生取代反应生成C7H7Cl为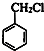 ,再发生水解反应得到A为
,再发生水解反应得到A为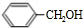 ,苯甲醇与乙二醇褪去1分子式水得到B为
,苯甲醇与乙二醇褪去1分子式水得到B为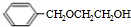 ,B发生消去反应生成C(
,B发生消去反应生成C(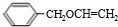 ).根据G的结构简式与转化关系可知,C4H6为CH2=CHCH=CH2,与溴发生1,4-加成生成D为BrCH2CH=CHCH2Br,D发生水解反应得到E为HOCH2CH=CHCH2OH,E发生与HCl发生加成反应得到F为HOCH2CH2CHClCH2OH,F发生氧化反应得到G,G发生消去反应、酸化得到I为HOOCCH=CHCOOH,则H为NaOOCCH=CHCOONa,H和C发生加聚反应生成P,则P的结构简式为:
).根据G的结构简式与转化关系可知,C4H6为CH2=CHCH=CH2,与溴发生1,4-加成生成D为BrCH2CH=CHCH2Br,D发生水解反应得到E为HOCH2CH=CHCH2OH,E发生与HCl发生加成反应得到F为HOCH2CH2CHClCH2OH,F发生氧化反应得到G,G发生消去反应、酸化得到I为HOOCCH=CHCOOH,则H为NaOOCCH=CHCOONa,H和C发生加聚反应生成P,则P的结构简式为: .
.
解答 解:结合C的结构简式可知C7H8为 ,由转化关系可知,甲苯与氯气在光照条件下发生取代反应生成C7H7Cl为
,由转化关系可知,甲苯与氯气在光照条件下发生取代反应生成C7H7Cl为 ,再发生水解反应得到A为
,再发生水解反应得到A为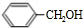 ,苯甲醇与乙二醇褪去1分子式水得到B为
,苯甲醇与乙二醇褪去1分子式水得到B为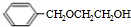 ,B发生消去反应生成C(
,B发生消去反应生成C(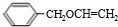 ).根据G的结构简式与转化关系可知,C4H6为CH2=CHCH=CH2,与溴发生1,4-加成生成D为BrCH2CH=CHCH2Br,D发生水解反应得到E为HOCH2CH=CHCH2OH,E发生与HCl发生加成反应得到F为HOCH2CH2CHClCH2OH,F发生氧化反应得到G,G发生消去反应、酸化得到I为HOOCCH=CHCOOH,则H为NaOOCCH=CHCOONa,H和C发生加聚反应生成P,则P的结构简式为:
).根据G的结构简式与转化关系可知,C4H6为CH2=CHCH=CH2,与溴发生1,4-加成生成D为BrCH2CH=CHCH2Br,D发生水解反应得到E为HOCH2CH=CHCH2OH,E发生与HCl发生加成反应得到F为HOCH2CH2CHClCH2OH,F发生氧化反应得到G,G发生消去反应、酸化得到I为HOOCCH=CHCOOH,则H为NaOOCCH=CHCOONa,H和C发生加聚反应生成P,则P的结构简式为: .
.
(1)反应①是甲苯与氯气在光照条件下生成 ,反应⑦是HOOCCH2CHClCOOH在氢氧化钠醇溶液、加热条件下发生的消去反应,
,反应⑦是HOOCCH2CHClCOOH在氢氧化钠醇溶液、加热条件下发生的消去反应,
故答案为:氯气、光照;氢氧化钠醇溶液、加热;
(2)反应③属于消去反应,反应⑥属于加成反应,
故答案为:消去反应;加成反应;
(3)E的结构简式为HOCH2CH=CHCH2OH,P的结构简式为: ,
,
故答案为:HOCH2CH=CHCH2OH; ;
;
(4)反应中⑦中将羟基氧化为羧基,也可以氧化碳碳双键,设计反应⑥⑦的目的是:保护碳碳双键,防止被氧化,
故答案为:保护碳碳双键,防止被氧化;
(5)符合下列要求的G的同分异构体:Ⅰ.能发生银镜反应,说明含有醛基,Ⅱ.只含两种化学环境不同的氢原子,Ⅲ.不含-O-O-结构,符合条件的同分异构体为: ,
,
故答案为: ;
;
(6)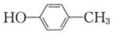 与溴发生取代反应生成
与溴发生取代反应生成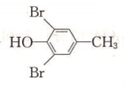 ,再与氢气发生加成反应得到
,再与氢气发生加成反应得到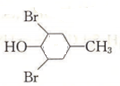 ,最后发生消去反应得到
,最后发生消去反应得到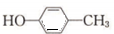 ,合成路线流程图为:
,合成路线流程图为: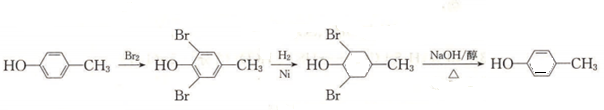 ,
,
故答案为: .
.
点评 本题考查了有机物推断与合成,充分利用转化关系中物质的结构、反应条件进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生分析推理能力,题目难度中等.

(1)他们测硝酸亚铁溶液的pH常温下小于7,用离子方程式解释其原因是Fe2++2H2O?Fe(OH)2+2H+
(2)甲同学欲配制硝酸亚铁溶液,为防止水解,称量一定量硝酸亚铁晶体溶于pH=1的稀硝
酸中,溶液呈深棕色,液面上方有红棕色气体,放置一段时间,溶液最终呈黄色.
(已知:Fe2+能与NO结合形成深棕色的[Fe(NO)]2+:Fe2++NO?〔Fe(NO)]2+)
①液面上方红棕色气体是NO2
②经检验黄色溶液中有Fe3+.检验Fe3+的操作是取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色
(3)甲同学继续用所得溶液进行实验.
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段时间后,溶液变为浅绿色 |
②甲认为由步骤i的现象得出SO2与NO3-发生了反应,没有与Fe3+发生反应,请判断甲的结论是否正确并说明原因:正确.溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+
③步骤ii溶液变为浅绿色,反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
④该实验得出的结论是SO2的还原性比Fe2+的强等
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 活泼非金属单质在氧化还原反应中只作氧化剂 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 含有某元素最高价态的化合物不一定具有强氧化性 |
| A. | 乙烯 | B. | 甲苯 | C. | 硝基苯 | D. | 甘油 |
| A. | 通入少量SO2,溶液漂白性增强 | |
| B. | 加入少量NaHCO3固体,c(ClO)减小 | |
| C. | 加入少量水,水的电离平衡向正方向移动 | |
| D. | 加入NaOH固体至恰好完全反应,一定有c(Na+)=c(Cl-)+c(ClO-)+c(HClO) |
| A. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| B. | 0.1 mol/L的AlCl3溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 25℃时,水电离出的c(H+)=1×l0-l3 mol/L的溶液中:K+、Ba2+、NO3-、S2- | |
| D. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
| A. | 1:2:3 | B. | 3:4:3 | C. | 6:3:2 | D. | 4:3:4 |

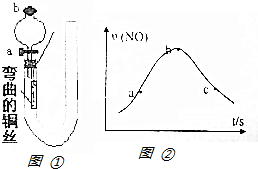 如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题:
如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题: