题目内容
工业上用CO生产燃料甲醇,发生反应:
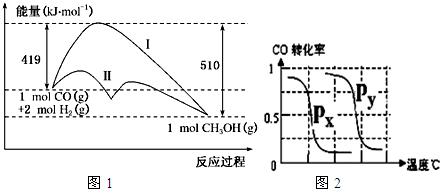
CO(g)+2H2(g)?CH3OH(g);△H 图1表示反应过程中能量的变化情况;
(1)在“图1”中,曲线 (填:Ⅰ或Ⅱ)表示使用了催化剂;该反应△H 0.(填“>”或“<”)
(2)一定条件下,在密闭容器中充入a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应.
①若容器容积不变,下列措施能使上述反应的反应速率增大,且平衡向正反应方向移动的是 .
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
E.选择高效催化剂
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件
已经填在下面实验设计表中
A.则上表中剩余的实验条件数据:a= 、b= .
B.根据反应Ⅱ的特点,图2是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px= MPa.
(3)已知:CH 3OH(g)+
O 2(g)=CO 2(g)+2H 2O(g)△H=-192.9kJ/molH 2O(l)=H 2O(g)△H=+44 kJ/mol,请写出表示CH 3OH(g)燃烧热的热化学方程式 .
CO(g)+2H2(g)?CH3OH(g);△H 图1表示反应过程中能量的变化情况;
(1)在“图1”中,曲线
(2)一定条件下,在密闭容器中充入a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应.
①若容器容积不变,下列措施能使上述反应的反应速率增大,且平衡向正反应方向移动的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
E.选择高效催化剂
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件
已经填在下面实验设计表中
| 实验编号 | T(℃) |
| P(MPa) | ||
| 1 | 150 |
| 0.1 | ||
| 2 | a |
| 5 | ||
| 3 | 350 | b | 5 |
B.根据反应Ⅱ的特点,图2是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=

(3)已知:CH 3OH(g)+
| 3 |
| 2 |
考点:化学平衡的影响因素,热化学方程式,转化率随温度、压强的变化曲线,等效平衡
专题:基本概念与基本理论
分析:(1)根据图中反应的活化能的大小来分析是否使用催化剂,利用反应前后的总能量来分析反应的能量变化;
(2)①据影响平衡移动和化学反应速率的因素解答;
②由图可知,横坐标为温度,纵坐标为CO的转化率,P1、P2为两种不同的压强,以此来分析实验数据;
(3)燃烧热是指1mol可燃物燃烧生成稳定化合物时放出的热量.
(2)①据影响平衡移动和化学反应速率的因素解答;
②由图可知,横坐标为温度,纵坐标为CO的转化率,P1、P2为两种不同的压强,以此来分析实验数据;
(3)燃烧热是指1mol可燃物燃烧生成稳定化合物时放出的热量.
解答:
解:(1)由图可知,曲线Ⅱ降低了反应所需的活化能,则Ⅱ使用了催化剂,又该反应中反应物的总能量大于生成物的总能量,则该反应为放热反应,△H<0,
故答案为:Ⅱ;<;
(2)①A、升温平衡向吸热的逆向移动,平衡常数减小,故A错误;
B、分离出甲醇,反应速率减慢,故B错误;
C、充入氦气,容器体积不变,反应物和生成物浓度不变,反应速率不变,故C错误;
D、容器容积不变,在充入反应物,反应物浓度增大,反应速率增大,平衡正向移动,故D正确;
E、加入催化剂,不影响平衡移动,个E错误;
故答案为:D;
②A.因图中横坐标为温度,纵坐标为CO的转化率,P1、P2为两种不同的压强,则实验中n(CO)/n(H2)相同,即b=
,为便于比较,则实验1和实验2的温度应相同,压强不同,即a=150,故答案为;150;
;
B.由图可知,相同温度时,Px对应的CO的转化率降低,则Px为0.1MPa,故答案为:0.1;
(3)燃烧热是指1mol可燃物燃烧生成稳定化合物时放出的热量,C生成二氧化碳,H生成液态水,据盖斯定律,表示CH 3OH(g)燃烧热的热化学方程式为:
①CH 3OH(g)+
O 2(g)=CO 2(g)+2H 2O(g)△H=-192.9kJ/mol,②H 2O(l)=H 2O(g)△H=+44 kJ/mol,①-②×2得:
CH 3OH(g)+
O 2(g)=CO 2(g)+2H 2O(l)△H=-280.9kJ/mol,
表示CH 3OH(g)燃烧热的热化学方程式为:
CH 3OH(g)+
O 2(g)=CO 2(g)+2H 2O(l)△H=-280.9kJ/mol,
故答案为:CH 3OH(g)+
O 2(g)=CO 2(g)+2H 2O(l)△H=-280.9kJ/mol.
故答案为:Ⅱ;<;
(2)①A、升温平衡向吸热的逆向移动,平衡常数减小,故A错误;
B、分离出甲醇,反应速率减慢,故B错误;
C、充入氦气,容器体积不变,反应物和生成物浓度不变,反应速率不变,故C错误;
D、容器容积不变,在充入反应物,反应物浓度增大,反应速率增大,平衡正向移动,故D正确;
E、加入催化剂,不影响平衡移动,个E错误;
故答案为:D;
②A.因图中横坐标为温度,纵坐标为CO的转化率,P1、P2为两种不同的压强,则实验中n(CO)/n(H2)相同,即b=
| 1 |
| 3 |
| 1 |
| 3 |
B.由图可知,相同温度时,Px对应的CO的转化率降低,则Px为0.1MPa,故答案为:0.1;
(3)燃烧热是指1mol可燃物燃烧生成稳定化合物时放出的热量,C生成二氧化碳,H生成液态水,据盖斯定律,表示CH 3OH(g)燃烧热的热化学方程式为:
①CH 3OH(g)+
| 3 |
| 2 |
CH 3OH(g)+
| 3 |
| 2 |
表示CH 3OH(g)燃烧热的热化学方程式为:
CH 3OH(g)+
| 3 |
| 2 |
故答案为:CH 3OH(g)+
| 3 |
| 2 |
点评:本题考查了催化剂对反应的影响、平衡移动的影响因素、平衡图象分析、转化率、盖斯定律的应用,题目难度中等.

练习册系列答案
相关题目
在-50℃的液氨中,存在如下电离平衡:2NH3=NH4++NH2-,其中NH4+的平衡浓度为1×10-15 mol/L,下列有关离子积的叙述中,正确的是( )
| A、离子积是1.0×10-15 |
| B、温度改变,其离子积不变 |
| C、在液氨中加入NaNH2晶体,则c(NH4+)将减少,离子积不变 |
| D、在液氨中加入NH4Cl晶体,则c(NH4+)将增大,离子积增加 |
在pH=12的溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Na+、Cl- |
| B、SO42-、Na+、NO3-、CO32- |
| C、Na+、HCO3-、NO3-、SO42- |
| D、Fe3+、Na+、Cl-、SO42- |
增大压强对下列反应的速率无影响的是( )
| A、CO2(g)+Ca(OH)2=CaCO3↓+H2O |
| B、H2+I2?2HI |
| C、NaCl+AgNO3=AgCl↓+NaNO3 |
| D、N2+3H2?2NH3 |
x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,则( )
| A、原子半径:x>y |
| B、电负性:x>y |
| C、离子半径:x<y |
| D、第一电离:x<y |
下列试剂的保存不正确的是( )
| A、漂白粉必须密封保存 |
| B、新制氯水用无色的广口瓶保存 |
| C、少量金属钠保存在煤油中 |
| D、液溴用一层水封盖再密封保存 |