题目内容
实验室里制备氯气可利用如下反应:
MnO2+ HCl(浓)
MnCl2+ Cl2↑+ H2O
(1)请配平上述化学方程式;
(2)用单线桥表示该反应的电子转移情况;
(3)浓盐酸在反应中显示出来的性质是 (填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)产生0.5mol Cl2,则转移的电子的物质的量为 mol.
| ||
(1)请配平上述化学方程式;
(2)用单线桥表示该反应的电子转移情况;
(3)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)产生0.5mol Cl2,则转移的电子的物质的量为
考点:氧化还原反应方程式的配平
专题:推断题
分析:(1)MnO2中Mn元素化合价为+4价,MnCl2中Mn元素化合价为+2价,Mn的化合价降低2;HCl中Cl元素化合价为-1价,Cl2中Cl元素化合价诶0价,Cl元素化合价升高为1,由于氯气为双原子分子,故MnO2和Cl2的化合计量数相等,均为1,再根据元素守恒配平整个化学方程式即可;
(2)根据失去电子的元素和得到电子的元素及转移的电子总数来标出电子转移的方向和数目,单线桥表示氧化还原反应方程式时箭头由失电子的元素出发指向得电子的元素,在箭头的短线上标明转移的电子数目即可;
(3)在氧化还原反应中,失电子化合价升高的元素被氧化;如果有盐酸的氢离子参加了反应而酸根离子未参加反应,那么盐酸就表现出酸性;
(4)由(2) (浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.
(浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.
(2)根据失去电子的元素和得到电子的元素及转移的电子总数来标出电子转移的方向和数目,单线桥表示氧化还原反应方程式时箭头由失电子的元素出发指向得电子的元素,在箭头的短线上标明转移的电子数目即可;
(3)在氧化还原反应中,失电子化合价升高的元素被氧化;如果有盐酸的氢离子参加了反应而酸根离子未参加反应,那么盐酸就表现出酸性;
(4)由(2)
 (浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.
(浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.解答:
解:(1)MnO2中Mn元素化合价为+4价,MnCl2中Mn元素化合价为+2价,Mn的化合价降低2;HCl中Cl元素化合价为-1价,Cl2中Cl元素化合价诶0价,Cl元素化合价升高为1,由于氯气为双原子分子,故MnO2和Cl2的化合计量数相等,均为1,再根据元素守恒配平整个化学方程式为MnO2+HCl(浓)
MnCl2+Cl2↑+H2O;
故答案为:1;4;1;1;2;
(2)该反应中Cl元素失去电子,Mn元素得到电子,转移的电子总数为2e-,则电子转移的方向和数目 (浓)═MnCl2+Cl2↑+2H2O,
(浓)═MnCl2+Cl2↑+2H2O,
故答案为: (浓)═MnCl2+Cl2↑+2H2O.
(浓)═MnCl2+Cl2↑+2H2O.
(3)反应中氯元素的化合价升高,则氯元素失去电子,该反应中部分盐酸中Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以浓盐酸作酸、还原剂,体现酸性和还原性;
故答案为:②;
(4)由(2) (浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.
(浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.
故答案为:1.
| ||
故答案为:1;4;1;1;2;
(2)该反应中Cl元素失去电子,Mn元素得到电子,转移的电子总数为2e-,则电子转移的方向和数目
 (浓)═MnCl2+Cl2↑+2H2O,
(浓)═MnCl2+Cl2↑+2H2O,故答案为:
 (浓)═MnCl2+Cl2↑+2H2O.
(浓)═MnCl2+Cl2↑+2H2O.(3)反应中氯元素的化合价升高,则氯元素失去电子,该反应中部分盐酸中Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以浓盐酸作酸、还原剂,体现酸性和还原性;
故答案为:②;
(4)由(2)
 (浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.
(浓)═MnCl2+Cl2↑+2H2O可看出每生成1mol氯气转移的电子数为2mol,所以产生0.5mol氯气将会转移1mol电子.故答案为:1.
点评:本题考查了氧化还原反应方程式的配平以及根据氧化还原反应方程式进行计算和用单线桥表示氧化还原反应,题目难度不大,只要掌握氧化还原反应的基本知识就能解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是( )
| A、将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3?H2O) |
| B、某溶液中只存在Cl-、OH、NH4+、H+四种离子,则一定不存在下列关系:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、将0.2 mol?L-1的某一元酸HA溶液和0.1 mol?L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol?L-1,则溶液的pH一定为14-a |
常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A、氨水中:NH4+、Fe2+、SO42-、HSO3- |
| B、pH=l的溶液中:Mg2+、Fe3+、Cl-、NO3- |
| C、通入足量CO2的溶液中:Ca2+、Na+、CO32-、SiO32- |
| D、水电离产生的c(H+)=1×10-14 mol?L-1的溶液中:Al3+、K+、Cl、CH3COO- |
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气.若砷的质量为1.50g,则( )
| A、被氧化的砒霜为1.98 g |
| B、分解产生的氢气为672 mL |
| C、和砒霜反应的锌为3.90 g |
| D、转移的电子总数为0.06NA |
以碳原子为中心与两个氯原子及两个碘原子相结合形成CCl2I2分子,以下判断正确的是( )
| A、CCl2I2分子是非极性分子 |
| B、CCl2I2分子含有π键 |
| C、CCl2I2分子是手性分子 |
| D、CCl2I2的沸点高于CCl4 |
下列实验操作正确的是( )
| A、用25mL碱式滴定管量取18.0mL KMnO4溶液 |
| B、在含有FeC12杂质的FeC13溶液中通入足量C12后,充分加热,即可得到纯净的FeC13溶液 |
| C、使用湿润的pH试纸测定气体的酸碱性 |
| D、为减小中和滴定误差,锥形必须用待测液润洗后才能使用 |
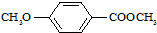
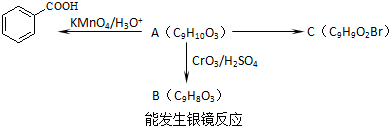
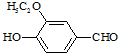 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.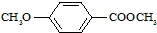 )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( 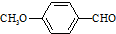 )合成X.用反应流程图表示如下:
)合成X.用反应流程图表示如下: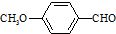 →
→