题目内容
15.农药波尔多液是一种广谱的保护性杀菌剂,广泛应用于果树、蔬菜和经济作物.波尔多液不能用铁或铝的容器贮存,是因为铁或铝能跟该农药中的硫酸铜发生化学反应,该反应属无机反应类型中的( )| A. | 化合反应 | B. | 中和反应 | C. | 氧化还原反应 | D. | 复分解反应 |
分析 氧化还原反应的特征是元素化合价的升降,可根据元素化合价的变化解答该题.
农药波尔多液不能用铁制容器盛放,原因是波尔多液中含有的铜离子能够与金属铁发生氧化还原反应,该反应属于置换反应.
解答 解:农药波尔多液不能用铁制容器盛放,原因是波尔多液中含有的铜离子能够与金属铁发生氧化还原反应,反应方程式为:2Al+3CuSO4═Al2(SO4)3+3Cu,有元素化合价的升降,故该反应属于氧化还原反应,
故选C.
点评 本题考查化学反应原理,难度不大,注意掌握常见的化学反应类型,明确化学反应原理.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
16.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 澄清的石灰水与稀盐酸反应:OH-+H+═H2O | |
| C. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
3.对于某些离子的检验和结论正确的是( )
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有$S{O}_{4}^{2-}$ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有$C{O}_{3}^{2-}$ |
10.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
在3min时达到平衡,下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 0.1 | 0.2 | 0 |
| 平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
| A. | 前3 min内,用Y的变化量表示的平均反应速率v(Y)=0.05mol•L-1•min-1 | |
| B. | 反应达到平衡时,X的转化率为50% | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 反应可表示为X+3Y?2Z,其平衡常数为1600 |
20.下列实验操作中,正确的是( )
| A. | 利用电泳现象区别溶液和胶体 | |
| B. | 用渗析的方法除去胶体中的离子或分子,以净化胶体 | |
| C. | 用滤纸过滤除去溶液中的胶体粒子 | |
| D. | 向新制Fe(OH)3胶体中加入足量AgNO3溶液,以除去胶体中的Cl- |
7. 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2 (g)═CH3CH2OH(g)+H2O(g)△H=256.1kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=41.2kJ•mol-1
已知:H2O(l)═H2O(g)△H=+44kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(l)△H=-305.7kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如下表:
①该反应是吸热反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2═OCO+3H2的平衡常数K=6.75.
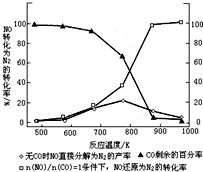
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式:CH4+2NO2=CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2 (g)═CH3CH2OH(g)+H2O(g)△H=256.1kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=41.2kJ•mol-1
已知:H2O(l)═H2O(g)△H=+44kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(l)△H=-305.7kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如下表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2═OCO+3H2的平衡常数K=6.75.
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式:CH4+2NO2=CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
4.能用铝槽车运输下列哪一种物质?( )
| A. | 盐酸 | B. | 氯水 | C. | 烧碱溶液 | D. | 浓硫酸 |
5.将Na投入FeCl3溶液中,可观察到的现象是( )
| A. | 生成白色沉淀 | B. | 生成红褐色沉淀,有气泡产生 | ||
| C. | 有铁生成 | D. | 无变化 |