题目内容
15.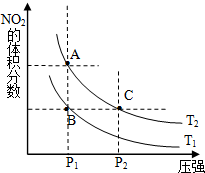 (1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).
(1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是0.1mol/L.
③计算②中条件下达到平衡后混合气体的平均相对分子质量为57.5;(结果保留小数点后一位)
分析 (1)正反应为吸热反应,升高温度平衡正向移动,平衡体系中NO2的体积分数增大;
A、C处于等温线上,压强越大反应速率越快;
(2)①60s处于平衡状态,平衡时n(N2O4)=0.08mol,则平衡时n(NO2)=0.4mol-0.08mol×2=0.24mol,再根据K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$计算平衡常数;
②该容器只充入的是N2O4气体,恒温恒容下,要达到上述同样的平衡状态,为等效平衡,按化学计量数转化应得到0.4mol的NO2,据此计算N2O4的起始浓度;
③题②的条件下达到平衡与原平衡为等效平衡,混合气体的平均相对分子质量相同,由表中数据可知,原反应在60s达平衡,根据差量法计算平衡时混合气体的总的物质的量,根据平均分子量=$\frac{气体总质量}{气体总物质的量}$计算.
解答 解:(1)正反应为吸热反应,升高温度平衡正向移动,平衡体系中NO2的体积分数增大,故温度T1<T2,
A、C两点都在等温线上,C的压强大,则A、C两点的反应速率:A<C,
故答案为:<;<;
(2)①60s处于平衡状态,平衡时n(N2O4)=0.08mol,则平衡时n(NO2)=0.4mol-0.08mol×2=0.24mol,故答案为K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{\frac{0.08}{2}}{(\frac{0.24}{2})^{2}}$=2.78,
故答案为:2.78;
②该容器只充入的是N2O4气体,恒温恒容下,要达到上述同样的平衡状态,为等效平衡,按化学计量数转化应得到0.4mol的NO2,故起始充入的N2O4气体物质的量为0.4mol×$\frac{1}{2}$=0.2mol,N2O4的起始浓度是 $\frac{0.2mol}{2L}$=0.1mol•L-1,
故答案为:0.1;
③题②的条件下达到平衡与原平衡为等效平衡,混合气体的平均相对分子质量相同,由表中数据可知,原反应在60s达平衡,平衡时N2O4为0.08mol,则:
2NO2?N2O4 物质的量减少△n
1 1
0.08mol 0.08mol
故反应后混合气体的总的物质的量为0.4mol-0.08mol=0.32mol,
混合气体平均相对分子质量为$\frac{0.4×46}{0.32}$=57.5
故答案为:57.5.
点评 本题考查化学平衡图象、化学平衡计算与影响因素与、化学平衡常数等,题目较为综合,难度中等,(2)中②注意等效平衡的利用.

| A. | 10a+b-14 | B. | 1014-a-b | C. | 1014+a-b | D. | 10a+b+14 |
| A. | 0.533L | B. | 0.267L | C. | 4.0L | D. | 2.0L |
| A. | 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 用FeS去除废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | KHS溶液中HS-的电离:HS-+H2O?H3O++S2- |
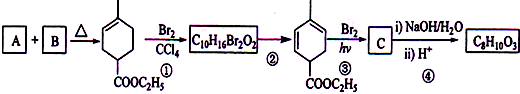
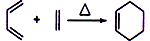
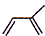 ,化学名称是2-甲基-1,3-丁二烯;
,化学名称是2-甲基-1,3-丁二烯;
 :
: