题目内容
7.(1)相同条件下,体积之比为a:b和质量之比为a:b的H2和O2的混合气体,其平均相对分子质量为$\frac{2a+32b}{a+b}$和$\frac{32(a+b)}{16a+b}$.(2)已知各物质参加反应的物质的量之比等于其在化学方程式中的计量数之比,气体化合物A的分子式可表示为OxFy,同温同压下,10mLA受热分解生成15mLO2和10mLF2,则A的化学式为O3F2,推断的依据为阿伏伽德罗定律和质量守恒定律.
分析 (1)设H2和O2物质的量分别为amol、bmol,根据m=nM计算质量,再根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均相对分子质量;
设H2和O2质量分别为ag、bg,根据n=$\frac{m}{M}$计算物质的量,再根据M$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均相对分子质量;
(2)10mLA受热分解生成15mLO2和10mLF2,根据气体的体积之比等于物质的量之比,则方程式中A、O2、F2的物质的量之比是10:15:10=2:3:2,即该反应的化学方程式为2A=3O2+2F2,根据质量守恒定律得A的化学式.
解答 解:(1)设H2和O2物质的量分别为amol、bmol,根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$可知平均相对分子质量为$\frac{2a+32b}{a+b}$;
设H2和O2质量分别为ag、bg,物质的量之比为$\frac{a}{2}$:$\frac{b}{32}$=16a:b,根据M$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$可知平均相对分子质量$\frac{16a×2+b×32}{16a+b}$=$\frac{32(a+b)}{16a+b}$,
故答案为:$\frac{2a+32b}{a+b}$;$\frac{32(a+b)}{16a+b}$;
(2)10mLA受热分解生成15mLO2和10mLF2,根据气体的体积之比等于物质的量之比,则方程式中A、O2、F2的物质的量之比是10:15:10=2:3:2,即该反应的化学方程式为2A=3O2+2F2,根据质量守恒定律得A的化学式为O3F2,推断的依据是阿伏伽德罗定律和质量守恒定律,
故答案为:O3F2;阿伏伽德罗定律和质量守恒定律.
点评 本题考查阿伏伽德罗定律、质量守恒定律的应用、物质的量有关计算,难度不大,注意对基础知识的理解掌握.

| A. | 64g/mol | B. | 32g/mol | C. | 16g | D. | 8g |
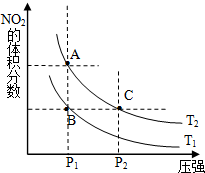 (1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).
(1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是0.1mol/L.
③计算②中条件下达到平衡后混合气体的平均相对分子质量为57.5;(结果保留小数点后一位)
| A. | 次氯酸电子式 | B. | 核内有8个中子的碳原子${\;}_{6}^{8}$C | ||
| C. | CO2的比例模型 | D. | 纯碱的化学式Na2CO3 |
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |

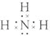 ;
; 一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1
一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1