题目内容
4.为确定某铝热剂(含氧化铁Fe2O3和铝)的组成,分别进行下列实验.(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体体积为6.72L(标准状况).反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;样品中铝的质量是5.4g.
(2)若另取a g样品将其加热引燃,恰好完全反应,该反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,则a为21.4 g.
(3)待(2)中反应产物冷却后,加入足量盐酸,反应的离子方程式为Fe+2H+=Fe2++H2↑和Al2O3+6H+=2Al3++3H2O,同时生成的气体在标准状况体积为4.48L.
分析 (1)铝热剂是金属铝和氧化铁的混合物,金属铝可以和氢氧化钠之间反应生成偏铝酸钠和氢气,根据氢气的体积计算金属铝的质量;
(2)金属铝和氧化铁的混合物反应生成金属铁和氧化铝,根据铝的物质的量计算出氧化铁的质量,然后得出铝和氧化铁的总质量;
(3)氧化铝、铁都能够与盐酸反应,分别写出反应的离子方程式;根据铝的物质的量计算出铁的物质的量及铁与盐酸反应生成氢气的物质的量,最后得出生成氢气的体积.
解答 解:(1)铝热剂是金属铝和氧化铁的混合物,金属铝可以和氢氧化钠之间反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,根据方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,当生成的氢气(标准状况,下同)体积为6.72L时,生成氢气的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,则样品中Al的质量为:0.3mol×$\frac{2}{3}$×27g/mol=5.4g,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;5.4;
(2)铝与氧化铁反应的方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,由于恰好完全反应,其中铝的物质的量是0.3mol×$\frac{2}{3}$=0.2mol,则氧化铁的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,质量为:160g/mol×0.1mol=16g,则铝和氧化铁的总质量为:5.4g+16g=21.4g,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;21.4;
(3)铝的物质的量是0.3mol×$\frac{2}{3}$=0.2mol,根据反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe可知反应产生铁的物质的量是0.2mol,
氧化铝、铁与盐酸反应的离子方程式为:Fe+2H+=Fe2++H2↑、Al2O3+6H+=2Al3++3H2O,
0.2mol铁完全反应产生氢气的物质的量为0.2mol,标准状况下0.2mol氢气的体积为:22.4L/mol×0.2mol=4.48L,
故答案为:Fe+2H+=Fe2++H2↑、Al2O3+6H+=2Al3++3H2O;4.48.
点评 本题考查了混合物反应的计算,题目难度中等,明确铝热反应原理为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案| A. | 用高氯酸与碳酸钙反应制取二氧化碳可证明氯元素非金属性大于碳元素 | |
| B. | 糖类、油脂、蛋白质在一定条件下都能发生水解反应 | |
| C. | 硅单质在电子工业上应用广泛,可做光导纤维 | |
| D. | 石油的裂化产生气体、植物油以及苯甲酸均能使酸性高锰酸钾溶液褪色 |
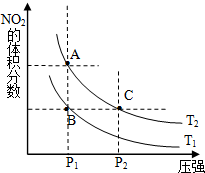 (1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).
(1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是0.1mol/L.
③计算②中条件下达到平衡后混合气体的平均相对分子质量为57.5;(结果保留小数点后一位)
| A. | 标准状况下,1mol H2完全燃烧生成气态水放出285.8kJ热量,则H2的燃烧热为-285.8kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后最高温度 | |
| C. | 在101 kPa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
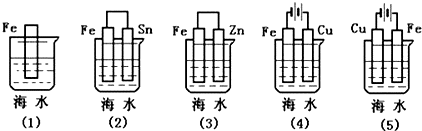
| A. | (5)(2)(1)(3)(4) | B. | (5)(2)(3)(1)(4) | C. | (4)(2)(1)(3)(5) | D. | (4)(2)(1)(5)(3) |
 一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1
一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1 两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液
两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液