题目内容
5.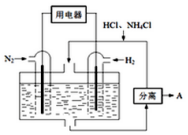 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | 通入H2一极为正极 | |
| B. | 分离出的物质A为HCl | |
| C. | 电池工作一段时间后,溶液pH减小 | |
| D. | 通入N2一极的电极反应式为N2+6e-+8H+═2NH4+ |
分析 以N2、H2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制造新型燃料电池,正极发生还原反应,氮气在正极获得电子,酸性条件下生成NH4+,该电池的正极电极反应式为:N2+8H++6e-=2NH4+,通入氢气的一极为负极,电极方程式为H2-2e-=2H+,总方程式为2N2+6H2+4H+=4NH4+,以此解答该题.
解答 解:A.通入氢气的一极为负极,电极方程式为H2-2e-=2H+,故A错误;
B.由总方程式为2N2+6H2+4H+=4NH4+,则分离出的物质A为NH4Cl,故B错误;
C.由总方程式为2N2+6H2+4H+=4NH4+,可知消耗H+,pH增大,故C错误;
D.氮气在正极获得电子,电极反应式为N2+6e-+8H+═2NH4+,故D正确;
故选D.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度判断氧化还原反应,确定正负极反应,为解答该题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.常温下,由水电离出C(H+)=1×10-13mol/L溶液中,一定能大量共存是( )
| A. | NH4+、Ba2+、Br-、CO32- | B. | K+、Na+、SO32-、MnO4- | ||
| C. | Al3+、Na+、AlO2-、Cl- | D. | Na+、Ba2+、Cl-、NO3- |
16.化学与生产、生活、科技、环境等密切相关,下列说法正确的是( )
| A. | 用加酶洗衣粉洗衣服时水的温度越高越好 | |
| B. | 用CO2合成聚碳酸酯可降解塑料能实现“碳”的循环 | |
| C. | 用纳米铁粉的吸附性去除污水中的Cu2+、Hg2+等重金属离子 | |
| D. | 用高锰酸钾溶液、酒精、双氧水的强氧化性进行杀菌消毒 |
20.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 试验操作 |
| A | 证明Mg的金属性强于Al | 分别向MgCl2、AlCl3溶液中加入足量的氨水 |
| B | 除去NH4Cl溶液中的Fe3+ | 加入氨水调节pH,过滤 |
| C | 检验Na2SO3是否已氧化变质 | 将Na2SO3样品溶于水中,滴加稀盐酸酸化的Ba(NO3)2溶液,观察是否有白色沉淀生成 |
| D | 检验碳单质与浓硫酸反应的产物 | 将生成的气体通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
| A. | A | B. | B | C. | C | D. | D |
3.对 的命名正确的是( )
的命名正确的是( )
 的命名正确的是( )
的命名正确的是( )| A. | 3-乙烯基-2-甲基丁烷 | B. | 2,3-二甲基-3-丁烯 | ||
| C. | 2,3-二甲基丁烯 | D. | 2,3-二甲基-1-丁烯 |
10.下列说法正确的是( )
| A. | 6.02×1023个分子的体积约是22.4L | |
| B. | 0.5mol H2的体积为11.2L | |
| C. | 标准状况下,1mol H2O的体积为22.4L | |
| D. | 标准状况下,体积相同的气体所含的分子数相同 |
7.下列电离方程式错误的是( )
| A. | (NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42- | |
| B. | Fe(OH)3溶于水:Fe(OH)3═3OH-+Fe3+ | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS=Na++HS-,HS-?H++S2- |
8.下列我国古代的技术应用中,其不涉及化学反应的是( )
| A. |  火药使用 | B. |  粮食酿酒 | ||
| C. |  活字印刷 | D. |  造纸技术 |