题目内容
7.下列电离方程式错误的是( )| A. | (NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42- | |
| B. | Fe(OH)3溶于水:Fe(OH)3═3OH-+Fe3+ | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS=Na++HS-,HS-?H++S2- |
分析 A.硫酸铵为强电解质,在溶液中完全电离;
B.氢氧化铁为弱电解质,电离方程式用可逆号;
C.氟化氢为强电解质,在溶液中部分电离出氟离子和氢离子;
D.硫氢化钠完全电离,硫氢根离子部分电离.
解答 解:A.(NH4)2SO4溶于水完全电离出铵根离子和硫酸根离子,其电离方程式为:(NH4)2SO4═2NH4++SO42-,故A正确;
B.Fe(OH)3溶于水部分电离,电离方程式应该用可逆号,正确的电离方程式为:Fe(OH)3?3OH-+Fe3+,故B错误;
C.HF溶于水部分电离出氢离子和氟离子,其电离方程式为:HF?H++F-,故C正确;
D.NaHS溶于水,硫氢化钠完全电离:NaHS=Na++HS-,硫氢根离子部分电离:HS-?H++S2-,故D正确;
故选B.
点评 本题考查了电离方程式的书写判断,题目难度不大,正确判断强弱电解质为解答关键,注意掌握电离方程式的书写原则,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
4.室温下,分别用0.1mol•L-1溶液进行下列实验,结论不正确的是( )
| A. | 向NaOH溶液中通SO2至pH=7:c(Na+)═c(HSO3-)+2c(SO32-) | |
| B. | 向NH4Cl溶液中加入等浓度等体积的NH3•H2O后,所得溶液呈碱性,则:c(NH4+)<c(NH3•H2O) | |
| C. | 向NH4HSO4加入等浓度等体积的NaOH溶液后后:c(NH4+)+c(NH3•H2O)═c(Na+) | |
| D. | 向CH3COOH溶液中加入少量CH3COONa晶体:$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ 增大 |
5.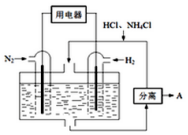 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | 通入H2一极为正极 | |
| B. | 分离出的物质A为HCl | |
| C. | 电池工作一段时间后,溶液pH减小 | |
| D. | 通入N2一极的电极反应式为N2+6e-+8H+═2NH4+ |
2.下列物质的分类正确的是( )
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | CaF2 | CO | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
| A. | A | B. | B | C. | C | D. | D |
12.25℃时,1mol/L醋酸加水稀释至0.01mol/L,下列变化正确的是( )
| A. | 溶液中c(OH-)减小 | B. | pH的变化值小于2 | ||
| C. | 溶液中H+的数目减小 | D. | Kw的值增大 |
19.生产、生活离不开化学.下列相关说法不正确的是( )
| A. | AgBr见光会分解,可用于制感光材料 | |
| B. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 | |
| C. | 过氧化钠可用作呼吸面具的供氧剂 | |
| D. | 食盐加碘单质可以消除碘缺乏症 |
16.区别下列有关物质的描述不正确的是( )
| A. | 用氢氧化钠溶液区别乙醇溶液和乙酸 | |
| B. | 用金属钠区别无水乙醇和苯 | |
| C. | 用碳酸钠溶液区别乙酸和乙酸乙酯 | |
| D. | 用溴水区别甲烷和乙烯 |
17.下列关于有机化合物的说法正确的是( )
| A. | 2-甲基丁烷也称为异丁烷 | |
| B. | 苯乙烯( )分子中所有原子都可能共平面 )分子中所有原子都可能共平面 | |
| C. | 一氯甲烷、二氯甲烷互为同系物 | |
| D. | 油脂和蛋白质都属于高分子化合物 |