题目内容
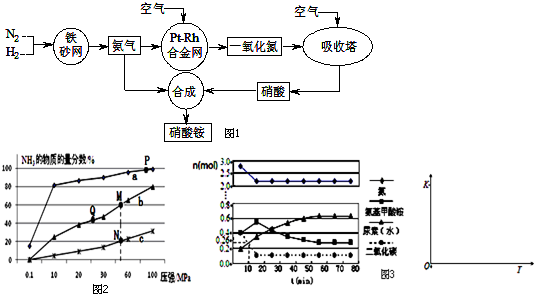
1. 如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置.装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol•L-1.不同时间电子天平的读数如下表所示:
如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置.装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol•L-1.不同时间电子天平的读数如下表所示:| 实验操作 | t/min | 电子天平的读数/g |
| 装置+硫酸溶液 | 320.0 | |
| 装置+硫酸溶液+样品 | 0 | 335.0 |
| 1 | 334.5 | |
| 2 | 334.1 | |
| 3 | 333.8 | |
| 4 | 333.8 |
②试计算样品中铝的质量分数?(写出计算过程)
③求反应后锥形瓶内硫酸溶液(溶液的体积变化忽略)的物质的量的浓度?(写出计算过程)
分析 测定铝粉(含铜粉等杂质不与酸反应)的纯度,Al与硫酸反应,而Cu不能,则生成氢气的质量为335.0g-333.8g=1.2g,结合2Al+3H2SO4=Al2(SO4)3+3H2↑计算.
解答 解:①反应中生成气体的质量为335.0g-333.8g=1.2g,
故答案为:1.2g;
②设含Al为xg,则
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 6
x 1.2g
$\frac{54}{x}=\frac{6}{1.2g}$,解的x=10.8g,
则样品中铝的质量分数为$\frac{10.8g}{335g-320g}$×100%=72.0%,
答:样品中铝的质量分数为72.0%;
③氢气的物质的量为$\frac{1.2g}{2g/mol}$=0.6mol,由反应可知,参加反应的硫酸的物质的量为0.6mol,剩余硫酸的物质的量为0.2L×4mol/L-0.6mol=0.2mol,则反应后锥形瓶内硫酸溶液(溶液的体积变化忽略)的物质的量的浓度为$\frac{0.2mol}{0.2L}$=1mol/L,
答:物质的量浓度1mol/L.
点评 本题考查化学方程式的计算,为高频考点,把握物质的量计算公式及化学反应中的物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列说法正确的是( )
| A. | 0.1mol•L-1的NaCl溶液表示的是1L溶剂中溶解0.1mol NaCl的溶液 | |
| B. | 将0.1mol氧化钠溶于水并配成1L溶液,则溶液的物质的量浓度为0.1mol•L-1 | |
| C. | 物质的量浓度和溶质质量分数均是表示溶液组成的物理量 | |
| D. | 0.1mol•L-1的CaCl2溶液中c(Cl-)也为0.1mol•L-1 |
9.反应A(g)+3B(g)?2C(g)+2D(g)分别从下列两条途径建立平衡:Ⅰ.A、B的起始物质的量分别为2mol和6mol;Ⅱ.C、D的起始物质的量均为2mol.在温度、压强恒定的条件下,以下叙述中不正确的是( )
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | 达平衡时,途径Ⅰ所得混合气体的密度为途径Ⅱ所得混合气体密度的$\frac{1}{2}$ | |
| C. | 达平衡时,途径Ⅰ的反应速率v(A)等于途径Ⅱ的反应速率v(A) | |
| D. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的平均相对分子质量相同 |
10.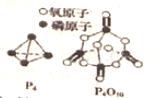 已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,则表中x(用含有a、b、c、d的代数式表示)为( )
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,则表中x(用含有a、b、c、d的代数式表示)为( )
 已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,则表中x(用含有a、b、c、d的代数式表示)为( )
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,则表中x(用含有a、b、c、d的代数式表示)为( ) | 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | a | b | c | x |
| A. | 12b-d-6a-5c | B. | -(d+6a+5c-12b) | C. | d+6a+5c-12b | D. | d+6a.5c-12b |
11.下列关于糖类、油脂、蛋白质的说法不正确的是( )
| A. | 蛋白质、纤维素、蔗糖、油脂都是高分子化合物 | |
| B. | 可用浓硝酸鉴别含苯环的蛋白质 | |
| C. | 工业上利用油脂在碱的催化作用下水解生产肥皂 | |
| D. | 淀粉水解与纤维素水解得到的最终产物相同 |