题目内容
12.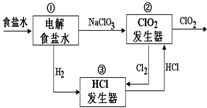 利用食盐水制取ClO2的工业流程如右图所示,
利用食盐水制取ClO2的工业流程如右图所示,装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑,
装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$2ClO2+Cl2↑+2NaCl+2H2O.
下列关于该流程说法不正确的是( )
| A. | 装置①中H2是阴极产物 | |
| B. | 装置②的阴极电极反应式为2ClO3-+12H++10e-=Cl2↑+6H2O | |
| C. | 该流程中Cl2、NaCl都可以循环利用 | |
| D. | 为了使H2完全转化为HCl,需要向装置③中补充Cl2 |
分析 A、装置①是电解食盐水,溶液中氢离子在阴极得到电子生成氢气;
B、装置②发生的反应是NaClO3和浓盐酸加热反应生成氯气、氯化钠和二氧化氯,阴极元素化合价变化和氧化还原反应概念分析;
C、电解食盐水得到氢气、氯气和氢氧化钠溶液,氢气和氯气反应生成氯化氢得到浓盐酸,制得NaClO3和浓盐酸加热反应生成ClO2;
D、生成的氢气和氯气反应生成氯化氢.
解答 解:A、装置①是电解食盐水,溶液中氢离子在阴极得到电子生成氢气,是阴极产物,故A正确;
B、电解食盐水得到氯酸钠(NaClO3)和H2,NaClO3和盐酸发生歧化反应,生成NaCl、2ClO2、Cl2、H2O,化学方程式为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,氯气是氧化产物,氯化钠中氯元素化合价不变,是盐酸氯化氢中氯元素生成,故B错误;
C、电解食盐水得到氢气、氯气和氢氧化钠溶液,氢气和氯气反应生成氯化氢得到浓盐酸,制得NaClO3和浓盐酸加热反应生成ClO2,2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl,该流程中Cl2、NaCl都可以循环利用,故C正确;
D、电解饱和食盐水生成的氢气,为了使H2完全转化为HCl,需要向装置③中补充Cl2,故D正确;
故选B.
点评 本题考查了海水资源的利用,二氧化氯制备的过程分析判断,主要是物质性质的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
2.下列说法正确的是( )
| A. | 向CH3CH2Br中加入NaOH溶液共热,再向反应后的溶液中滴入AgNO3溶液以检验溴元素 | |
| B. | 利用红外光谱图,可以鉴别CH3OCH3和CH3CH2OH | |
| C. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,以检验混合物中是否含有甲醛 | |
| D. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 |
3.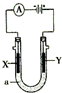 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )
 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )| A. | 若X、Y为石墨,a为饱和NaCl溶液,向Y极附近加入酚酞,则Y极溶液呈红色 | |
| B. | 若X、Y是石墨,a为AgNO3溶液,电解一段时间后,溶液的pH减小 | |
| C. | 若用电解方法精炼粗铜,电解液a选用CuSO4溶液,X电极的材料是粗铜 | |
| D. | 若Y为铁,X为石墨,a为稀硫酸,Y电极反应为Fe-3e-=Fe3+ |
20.Na2FeO4是一种高效的水处理剂,下列用于解释事实的离子方程式中不正确的是( )
| A. | Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:4FeO42-+10H2O+4Fe3+=20OH-+3O2↑ | |
| B. | 工业上可用FeCl3、NaOH、NaClO三种物质反应制得NaFeO4离子方程式为:2Fe3++10OH-+3ClO-=2FeO42-+3Cl-+5H2O | |
| C. | NaFeO4消毒杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是:Fe3++3H2O?Fe(OH)3+3H+ | |
| D. | 工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为:Fe-6e-+8OH-=FeO42-+4H2O |
17.下列说法中正确的是( )
| A. | 能使石蕊溶液呈红色的溶液:Fe2+、Na+、Ba2+、Cr2O72-可以大量共存 | |
| B. | 氢氧化钡溶液与等物质的量的稀硫酸混合,离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 50℃,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 25℃,pH相同的NaOH、CH3COONa、Na2CO3、NaHCO3溶液的浓度c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3) |
4.下列分子在限定条件下的同分异构体数目不为4的是( )
| A. | C4H8O2属于酯的同分异构体 | B. | C5H10O2属于酸的同分异构体 | ||
| C. | 甲苯的一氯取代物 | D. | 化合物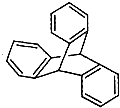 的一氯取代物 的一氯取代物 |
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 水电离出的c(H+)=1×10-14mol•L-1的溶液中:Ba2+、NO3-、K+、SO32- | |
| C. | 使苯酚显紫色的溶液中:NH4+、Na+、Cl-、SCN- | |
| D. | 使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3- |