题目内容
15. 酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.
酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.回答下列问题:
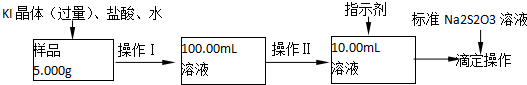
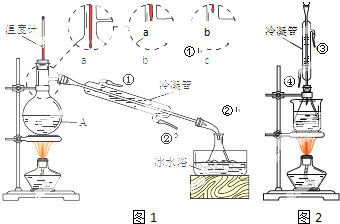
(1)米酒中乙醇含量可采用蒸馏法测定,装置如图I所示.仪器A的名称是蒸馏烧瓶;A中温度计的位置正确的是b(选填a、b或c);
(2)收集乙醇的锥形瓶需置于冰水浴中,其目的是减少乙醇挥发,防止影响测定结果(作用是冷凝).欲收集无水乙醇,可加入足量的生石灰(填物质名称)后再进行蒸馏.
(3)为测定某白酒样品的总酸量,取20.00mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010mol/L的NaOH标准溶液滴定至终点.判断终点的依据是溶液由无色变为粉红色,半分钟内不褪色.若该白酒样品为优质级,则消耗NaOH溶液体积应不小于10.00mL.
(4)白酒中的总酯量可用返滴法测定.往上题滴定后的溶液(恰好至终点)中再加入20.00mL 0.100mol/L NaOH标准溶液,用图II装置水浴加热半小时.冷却后用0.100mol/L的硫酸标准溶液滴定至终点.
加热半小时的目的是使酯水解完全.已知最终消耗硫酸标准溶液7.70mL,该白酒样品中总酯量为2.024g/L.
(5)下列操作会使总酯量测定结果偏高的是c(选填编号)
a.加热时未使用水浴和冷凝管
b.选用了甲基橙为指示剂
c.滴定前滴定管内无气泡,滴定后产生气泡
d.滴定管未用硫酸标准溶液润洗
(6)图I和图II的装置中均用到了冷凝管,其进水口分别为b(选填编号)
a.①③b.②④c.②③d.①④
分析 (1)蒸馏时用蒸馏烧瓶,温度计水银球位置在支管口处;
(2)从乙醇的性质分析;乙醇和乙酸易挥发,水也易挥发,故加入生石灰和乙酸反应吸收水;
(3)当滴定终点时,溶液显碱性,酚酞由无色变为粉红色,根据优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L计算需要氢氧化钠的体积;
(4)加热促进水解,根据消耗硫酸量来计算和硫酸反应的氢氧化钠的量,从而可计算出酯水解需要碱的量,进而计算出酯的量;
(5)根据消耗酸的量来确定误差,若耗酸多,则计算出的酯量少,偏低,反之偏高,据此分析;
(6)冷凝水中采用逆向通水,冷凝效果更好.
解答 解:(1)根据仪器A的构造可知,其名称为蒸馏烧瓶;温度计水银球位置在支管口处,以便于测量流出蒸气的温度,所以A中温度计的位置正确的是b,
故答案为:蒸馏烧瓶;b;
(2)乙醇易挥发,为了减少乙醇的挥发,采用冰水冷凝的方法;乙醇和乙酸易挥发,水也易挥发,故欲收集无水乙醇时,可加入生石灰除去乙酸和水,
故答案为:减少乙醇挥发,防止影响测定结果(作用是冷凝);生石灰;
(3)当滴定终点时,溶液显碱性,酚酞由无色变为粉红色,所以滴定终点的现象为:溶液由无色变为粉红色,半分钟内不褪色;
根据优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,
则20.00mL样品含乙酸:0.02L×0.30g/L=0.006g,
CH3COOH+NaOH=CH3COONa+H2O
60g 1mol
0.006g 0.01V
解得:V=0.01L=10.00mL,
故答案为:溶液由无色变为粉红色,半分钟内不褪色;10.00;
(4)加热可促进酯的水解速率,使酯水解完全;
滴定耗硫酸的物质的量:0.1mol/L×7.7mL=0.77mmol,中和氢氧化钠的物质的量为:0.77mmol×2=1.54mmol,
酯水解消耗氢氧化钠物质的量为:20.00mL×0.100mol/L-1.54mmol=0.46mmol,故酯的物质的量为0.46mmol,质量为:0.46mmol×88g/mol=40.48mg,
故该样品总酯量为:$\frac{40.48mg}{20ml}$=2.024g/L,
故答案为:使酯水解完全;2.024;
(5)根据消耗酸的量来确定误差,若耗酸多,则计算出的酯量少,偏低,反之偏高.
a.加热时未使用水浴和冷凝管,酯挥发结果偏低;
b.甲基橙变色范围为3.1-4.4,在酸性范围内变色,酸消耗多,结果偏低;
c.滴定前滴定管内无气泡,滴定后产生气泡,酸消耗体积读数偏小,结果偏高;
d.滴定管未用硫酸标准溶液润洗,耗酸多,结果偏低;
故答案为:c;
(6)冷凝水从下口进上口出,冷凝效果好,所以图Ⅰ和图Ⅱ中的冷凝管的进水口分别为②、④,
故答案为:b.
点评 本题考查了探究物质组成与含量的方法,题目难度中等,明确中和滴定操作方法为解答关键,注意熟练掌握化学实验基本操作方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.

| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | 常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
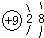 ⑤$\stackrel{+2}{M}g$( )
⑤$\stackrel{+2}{M}g$( )| A. | ①② | B. | ②④ | C. | ③④ | D. | ③⑤ |
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应的水化物的碱性:Y>R>X | |
| D. | 相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z |
| A. | ⅠA | B. | ⅡA | C. | ⅣA | D. | ⅦA |