题目内容
7.几种短周期元素的原子半径及主要化合价见下表:| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应的水化物的碱性:Y>R>X | |
| D. | 相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z |
分析 X和Y的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知Y为Be,X为Mg;
Z和T的化合价都有-2价,应为周期表第ⅥA族元素,Z的最高价为+6价,Z应为S元素,T无正价,T应为O元素;
RM的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于Z小于X可知应和X同周期,R为Al元素,结合元素周期律知识解答该题.
解答 解:X和Y的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知Y为Be,X为Mg;
Z和T的化合价都有-2价,应为周期表第ⅥA族元素,Z的最高价为+6价,Z应为S元素,T无正价,T应为O元素;
RM的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于Z小于X可知应和X同周期,R为Al元素,
A.Mg比Al活泼,Mg与盐酸反应较剧烈,故A错误;
B.T2->X2+具有相同的核外电子排布,则核电荷数越大,离子半径越小,故B正确;
C.Mg比Al的金属性强,元素的金属性越强,对应的最高价氧化物对应的水化物的碱性越强,故C错误;
D.Z为S元素,T为O元素,非金属性:O>S,水分子的稳定性大于硫化氢,则H-S的键能小于H-O键,所以相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z,故D正确.
故选BD.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,明确原子结构与元素化合价、原子半径之间的关系为解答关键,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
18.已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某化学兴趣研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8℃,沸点是44.8℃.
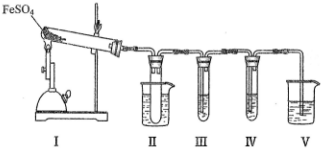
(1)装置II的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶).
(2)装置II的试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(3)装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
(4)装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是NaOH溶液.

(1)装置II的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶).
(2)装置II的试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(3)装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入BaCl2溶液 | 产生白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入酸性 KMnO4 溶液 | 若溶液紫色褪去, 证明气体产物中含有SO2, 若溶液紫色无明显变化, 证明气体产物中不含SO2 |
2. 在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )
在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )
 在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )
在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )| A. | 甲:浓硫酸和木炭 乙:浓氨水和SO2 | |
| B. | 甲:双氧水和MnO2 乙:饱和食盐水和HCl | |
| C. | 甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | |
| D. | 甲:浓硫酸和蔗糖(滴有几滴水) 乙:氯化亚铁溶液和硫化氢 |
12.校园“毒跑道”事件媒体常有报道,其对人体造成伤害的原因之一是超标使用了苯、甲苯等有机溶剂.下列有关说法正确的是( )
| A. | 甲苯的分子式为: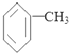 | |
| B. | 甲苯分子中所有原子都处于同一平面 | |
| C. | 甲苯的一氯取代物有5种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 甲苯和苯互为同系物 |
19.在常温常压下,烯烃与氢气混合并不起反应,甚至在高温时反应也很慢.但在适当的催化剂存在下与氢气反应生成烷,一般认为加氢反应是在催化剂表面进行.反应过程的示意图如下:下列说法中正确的是( )
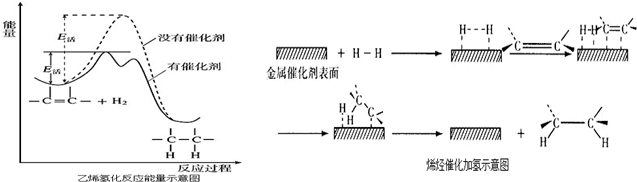

| A. | 乙烯和H2生成乙烷的反应是吸热反应 | |
| B. | 加入催化剂,可减小反应的热效应 | |
| C. | 催化剂能改变平衡转化率,不能改变化学反应的平衡常数 | |
| D. | 催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体 |
16.下列说法正确的是( )
| A. | 某试样焰色反应呈黄色,则试样中可能含有K+ | |
| B. | 广泛pH试纸测得某新制氯水的pH为4 | |
| C. | 配制240ml某溶液,应选240ml容量瓶 | |
| D. | 可用排饱和食盐水来收集纯净的氯气 |
17.下列反应不属于取代反应的是( )
| A. | 苯与浓硫酸反应 | B. | 乙醇与HBr溶液共热制溴乙烷 | ||
| C. | 乙醇和浓硫酸共热至170℃ | D. | 油脂与强碱水溶液反应 |
 酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.
酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.