题目内容
6.下列说法正确的是( )| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | 常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
分析 A.二氧化硫与品红不发生氧化还原反应;
B.常温下铜与浓硫酸不反应;
C.铁与稀硝酸反应生成NO;
D.液面均迅速上升,说明烧瓶内压强减小.
解答 解:A.二氧化硫与品红发生化合反应生成不稳定的物质,不发生氧化还原反应,故A错误;
B.常温下铜与浓硫酸不反应,故B错误;
C.铁与稀硝酸反应生成NO,没有生成氢气,不是置换反应,故C错误;
D.液面均迅速上升,说明烧瓶内压强减小,可说明气体易溶于水,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,注意把握常见物质的性质的异同,难度不大.

练习册系列答案
相关题目
16.下列有关钠的叙述中错误的是( )
| A. | 电解法冶炼金属钠时,钠在阳极析出 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| D. | 钠的质地软,可用小刀切割 |
1.下列解释事实的方程式正确的是( )
| A. | 将NO2通入水中,红棕色消失:3NO2+H2O═2HNO3+O2 | |
| B. | 向含有Hg2+的废水中加入Na2S 产生沉淀:Hg2++S2-═Hg+S↓ | |
| C. | Na 与水反应产生气体:2Na+H2O═2Na++2OH-+H2↑ | |
| D. | 向燃煤中加入石灰石可减少 SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2 |
11.下列关于原电池的叙述中,正确的是( )
| A. | 原电池的电极一定要由两种不同的金属组成 | |
| B. | 原电池的负极得电子,发生还原反应 | |
| C. | 原电池工作时,其正极不断产生电子并经外电路流向负极 | |
| D. | 原电池能将化学能转化为电能 |
18.已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某化学兴趣研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8℃,沸点是44.8℃.
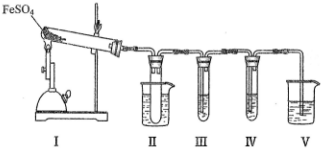
(1)装置II的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶).
(2)装置II的试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(3)装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
(4)装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是NaOH溶液.

(1)装置II的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶).
(2)装置II的试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(3)装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入BaCl2溶液 | 产生白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入酸性 KMnO4 溶液 | 若溶液紫色褪去, 证明气体产物中含有SO2, 若溶液紫色无明显变化, 证明气体产物中不含SO2 |
16.下列说法正确的是( )
| A. | 某试样焰色反应呈黄色,则试样中可能含有K+ | |
| B. | 广泛pH试纸测得某新制氯水的pH为4 | |
| C. | 配制240ml某溶液,应选240ml容量瓶 | |
| D. | 可用排饱和食盐水来收集纯净的氯气 |
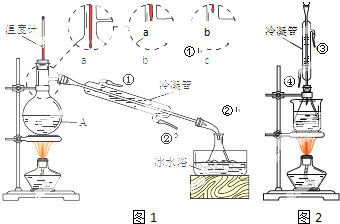 酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.
酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.