题目内容
10.写出下面的反应方程式或离子化学方程式:(1)钠与氧气:常温:4Na+O2=2Na2O点燃:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(2)钠与水反应:2Na+2H2O=2NaOH+H2↑离子方程式:2Na+2H2O=2Na++2OH-+H2↑
(3)过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2↑
(4)铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 (1)钠与氧气常温下生成氧化钠,点燃生成过氧化钠;
(2)钠与水反应生成氢氧化钠和氢气;
(3)过氧化钠与二氧化碳反应生成碳酸钠和氧气;
(4)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:(1)钠与氧气常温下生成氧化钠,化学方程式4Na+O2=2Na2O,点燃生成过氧化钠,化学方程式2Na+O2 $\frac{\underline{\;点燃\;}}{\;}$ Na2O2;
故答案为:4Na+O2=2Na2O;2Na+O2 $\frac{\underline{\;点燃\;}}{\;}$ Na2O2;
(2)钠与水反应生成氢氧化钠和氢气,化学方程式;2Na+2H2O=2NaOH+H2↑;离子方程式:2Na+2H 2O=2Na++2OH-+H2↑;
故答案为:2Na+2H2O=2NaOH+H2↑;2Na+2H 2O=2Na++2OH-+H2↑;
(3)过氧化钠与二氧化碳反应生成碳酸钠和氧气,化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑;
故答案为:2Na2O2+2CO2=2Na2CO3+O2↑;
(4)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑; 2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,注意反应条件对反应的影响,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
20.下列溶液中通入过量的CO2气体后,溶液变浑浊的是( )
| A. | 苯酚钠 | B. | 酯酸钠 | C. | 氢氧化钠 | D. | 石灰水 |
18.天然气是一种很重要的清洁能源,其主要成分为CH4.下列说法正确的是( )
| A. | 常温常压下CH4是液体 | B. | 一氯甲烷分子式为CH4Cl | ||
| C. | CH4与Cl2可以发生加成反应 | D. | CH4完全燃烧生成CO2和H2O |
5.化学式为C9H12的芳香烃的一卤代物数目和化学式为C7H8O且遇FeCl3溶液显紫色的芳香族化合物数目分别为( )
| A. | 7种和2种 | B. | 8种和3种 | C. | 42种和3种 | D. | 56种和3种 |
2.用石英砂和焦炭在高温下可以获得粗硅,其反应方程式如下:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO.下列有关该反应的说法正确的是( )
| A. | SiO2是还原剂 | B. | C被氧化 | ||
| C. | SiO2发生氧化反应 | D. | O得到电子 |
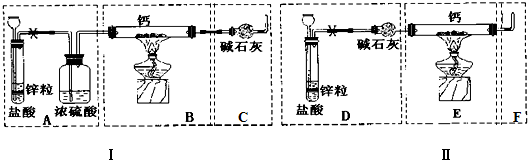
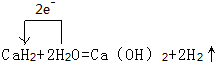 ,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象
,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象
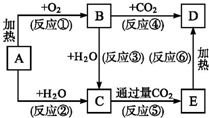 框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.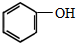 (制酚醛树脂)
(制酚醛树脂) 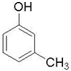 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )