题目内容
20. 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:(1)反应需在50℃~60℃的温度下进行,图中给反应物加热的方法是水浴加热,其优点是受热均匀、和温度便于控制;
(2)在配制混合酸时应将浓硫酸加入到浓硝酸中去;
(3)该反应的化学方程式是
 ;反应类型:取代反应
;反应类型:取代反应(4)由于装置的缺陷,该实验可能会导致的不良后果是苯、浓硝酸等挥发到空气中,造成污染.
(5)反应完毕后,除去混合酸,所得粗产品用如下操作精制:
①蒸馏 ②水洗 ③用干燥剂干燥 ④用10%NaOH溶液洗 ⑤水洗
正确的操作顺序是B.
A.①②③④⑤B.②④⑤③①C.④②③①⑤D.②④①⑤③
分析 (1)反应控制在50℃~60℃的温度下,使用水浴加热,受热均匀,便于控制;
(2)防止浓硫酸溅出,浓硝酸的密度小于浓硫酸的密度,因此两种酸混合时,把浓硫酸慢慢加入到浓硝酸中,边加边搅拌;
(3)苯与浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成硝基苯;
(4)苯是挥发性液体,硝酸挥发,会造成污染空气;
(5)硝基苯中混有混合酸,先用水洗,除去大部分混合酸,然后用10%NaOH洗涤,除去剩下的酸,然后再用水洗,除去碱,接着用干燥剂除去水,最后蒸馏得到溴苯.
解答 解:(1)水浴加热的优点是:受热均匀、温度便于控制,故答案为:受热均匀、温度便于控制;
(2)浓硝酸的密度小于浓硫酸的密度,因此两种酸混合时,把浓硫酸慢慢加入到浓硝酸中,边加边搅拌,故答案为:浓硫酸;浓硝酸;
(3)苯和浓硝酸发生硝化反应,硝基取代苯环上的一个氢原子,其反应方程式: ,为取代反应,
,为取代反应,
故答案为: ;取代反应;
;取代反应;
(4)苯是挥发性液体,硝酸易挥发,根据装置图的特点,会造成苯、硝酸的挥发污染空气,
故答案为:苯、浓硝酸等挥发到空气中,造成污染;
(5)硝基苯中混有混合酸,先用水洗,除去大部分混合酸,然后用10%NaOH洗涤,除去剩下的酸,然后再用水洗,除去碱,接着用干燥剂除去水,最后蒸馏得到溴苯,故选:B.
点评 本题考查硝基苯制备实验,题目基础性强,贴近教材,有利于基础知识的巩固与培养学生的实验能力.

练习册系列答案
相关题目
15.基因测序研究中,常用${\;}_{15}^{32}$P作标记物,下列关于${\;}_{15}^{32}$P的说法正确的是( )
| A. | 质子数为32 | B. | 质量数为15 | ||
| C. | ${\;}_{15}^{32}$P与${\;}_{15}^{33}$P互为同位素 | D. | 中子数为15 |
12.下列各组中,互为同素异形的是( )
| A. | 氕(${\;}_{1}^{1}$H)和氘(${\;}_{1}^{2}$H) | B. | O2和O3 | ||
| C. | 水和冰 | D. | NO和NO2 |
10.一定能在下列溶液中大量共存的离子组是( )
| A. | 碱性溶液:Na+、Ca2+、SO42-、CO32- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | 氯水溶液:H+、Fe2+、SO42-、Cl- | |
| D. | 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |

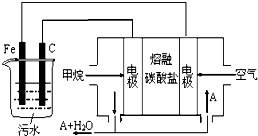 FeCl3具有净水作用,但腐蚀设备,所以工业上常选用电浮选凝聚法处理污水.其原理是保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.某课外小组用电浮选凝聚法处理污水,设计如图所示装置示意图.
FeCl3具有净水作用,但腐蚀设备,所以工业上常选用电浮选凝聚法处理污水.其原理是保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.某课外小组用电浮选凝聚法处理污水,设计如图所示装置示意图. 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.